Charles ‘s Law
프랑스 물리학 자 Jacques Charles (1746-1823)는 온도의 영향을 연구했습니다. 일정한 압력에서 가스의 부피에 대한 Charles의 법칙은 압력이 일정하게 유지 될 때 주어진 가스 질량의 부피가 가스의 절대 온도에 따라 직접적으로 변한다고 말합니다. 절대 온도는 켈빈 눈금으로 측정 한 온도입니다. 켈빈 스케일의 0은 분자 운동의 완전한 정지에 해당하므로 켈빈 스케일을 사용해야합니다.
수학적으로 Charles의 법칙의 직접적인 관계는 다음 방정식으로 나타낼 수 있습니다.
\
보일의 법칙과 마찬가지로 \ (k \)는 주어진 가스 샘플에 대해서만 일정합니다. 아래 표는 일정한 압력에서 설정된 양의 가스에 대한 온도 및 부피 데이터를 보여줍니다. 세 번째 열은이 특정 데이터 세트에 대한 상수이며 항상 부피를 켈빈 온도로 나눈 값과 같습니다.
이 데이터를 그래프로 표시하면 결과는 직선으로 표시되어 직접적인 관계를 나타냅니다. 아래 그림과 같습니다.
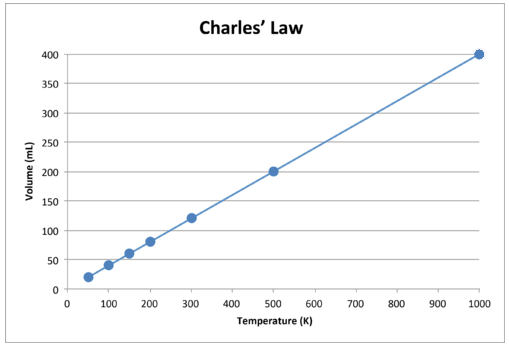
그림 \ (\ PageIndex {2} \) : 가스의 양은 다음과 같이 증가합니다. 켈빈 온도가 상승합니다.
선이 정확히 원점을 향해 가고 있습니다. 즉, 가스의 절대 온도가 0에 가까워지면 부피가 0에 가까워집니다. 그러나 가스가 극도로 낮은 온도에 도달하면 분자는 결국 절대 0에 도달하기 전에 액체 상태로 응축됩니다. 액체 상태로의 이러한 변화가 발생하는 온도는 기체마다 다릅니다.
\
이 방정식은 다른 세 가지가 알려진 경우 네 가지 양 중 하나를 계산하는 데 사용할 수 있습니다. . 직접적인 관계는 온도가 켈빈으로 표현되는 경우에만 유지됩니다. 섭씨 온도는 작동하지 않습니다. \ (\ text {K} = \ : ^ \ text {o} \ text {C} + 273 \)이라는 관계를 상기하십시오.
