Introduktion
Sukkerrør (Saccharum spp., Poaceae) er en årlig eller flerårig afgrøde dyrket i tropiske og subtropiske regioner verden over. Sukkerrør er en vigtig afgrøde til produktion af saccharose og tegner sig for 70% af verdens sukkerproduktion. Derudover kan sukkerrør som et C4-anlæg effektivt omdanne solenergi til kemisk energi og er derfor en ideel biobrændstofafgrøde til ethanolproduktion (Lam et al., 2009; Santchurn et al., 2014). Slægten Saccharum har seks arter: S. spontaneum, S. robustum, S. officinarum, S. barberi, S. sinense og S. edule, blandt hvilke S. spontaneum betragtes som den vilde art med et basisk kromosomsæt på x = 8. S. spontaneum er også en af de to vigtigste Saccharum-arter, der bidrager til den moderne udvikling af sukkerrørsorter (Dhont et al., 1998; Ha et al., 1999). S. spontaneum har en stærk miljøtilpasningsevne og indeholder vigtige genetiske træk til sygdoms- og tørkebestandighed og bidrager således til stresstolerancen for moderne kultivhybrider (Grivet et al., 2004). S. spontaneum har den bredeste geografiske fordeling, og dens ploidniveauer spænder fra 2n = 5x = 40 til 2n = 16x = 128 (Panje og Babu, 1960).
Sukkerrørskromosomer har lignende morfologier og har en lille størrelse på 1-6 um ved det kondenserede metafasetrin (Ha et al., 1999; Dhont, 2005); derfor er det meget udfordrende at skelne mellem de forskellige kromosomer baseret på traditionelle cytogenetiske metoder. Desuden er dens kromosomale strukturelle ændringer som autopolyploid forårsaget af polyploidisering, duplikering, sletning og rekombination meget almindelige (Piperidis et al., 2010). I S. spontaneum er der udviklet genetiske koblingskort (Silva et al., 1995), men udviklingen af et cytologisk genetisk kort hænger efter andre græsarter. Pålidelige cytologiske værktøjer til at identificere individuelle kromosomer kan bruges til effektiv genomforskning og udnyttelse af kimplasmeressourcer, specifikt med den komplekse genombaggrund for moderne sukkerrørsorter. Kromosomsspecifikke bakterielle kunstige kromosomkloner (BAC) er uvurderlige ressourcer til sukkerrørgenforskning og vil have mange anvendelser inden for fysisk kortlægning, kromosomidentifikation og markørassisteret opdræt af Saccharum spp. Og til at hjælpe sukkerrørsekvensering og samlingsprojekter. .
Fluorescens in situ-hybridisering (FISH) er et kraftfuldt værktøj til molekylær cytologi (Jiang og Gill, 2006). I Saccharum spp. Blev 45S rDNA og 5S rDNA anvendt som sonder til at detektere de basiske kromosomer af S. spontaneum, S. robustum og S. officinarum til at identificere de forskellige basiske kromosomer, x = 8 i S. spontaneum og x = 10 i S. robustum og S. officinarum (Dhont et al., 1998; Ha et al., 1999). Baseret på FISH viste det sig, at moderne sukkerrørsorter indeholdt 70-80% af kromosomerne afledt af S. officinarum og 10-23% af kromosomerne fra S. spontaneum, mens 5-17% ser ud til at være produktet af rekombinationen mellem S. spontaneum og S. officinarum (Dhont et al., 1996; Piperidis et al., 2001; Cuadrado et al., 2004). Desuden blev kromosomeliminering, rekombination og translokationshændelser påvist i nogle stamfædre afledt af hybridiseringen mellem Saccharum og Erianthus arundinaceus ved anvendelse af FISH (Dhont et al., 1995; Huang et al., 2015).
Sorghum har et lille diploid genom (730 Mbp) med en lav frekvens af kromosom rekombinationshændelser. Sorghum deler høj syntethed med sukkerrørgenomet, hvilket gør det til et ideelt referenceplant til sammenlignende analyser med sukkerrørgenomet (Ming et al., 1998; Nazeema et al., 2007; Wang et al., 2010; Aitken et al., 2014 ). I denne undersøgelse, baseret på de tilgængelige sekvenser for BAC-ressourcer med høj dækning, blev der udviklet pålidelige BAC-sonder til FISH-kromosomidentifikation og cytogenetisk kortkonstruktion. Formålet med denne undersøgelse var at: (1) udvikle et sæt kromosomspecifikke BAC-FISH-sonder på S. spontaneum-kromosom og (2) udforske kromosomomlægningen mellem S. spontaneum og sorghum.
Materialer og metoder
Materialer
Saccharum spontaneum SES208 (2n = 8x = 64) blev anvendt til cytologiske analyser i denne undersøgelse. SES208-planterne blev dyrket i marken på campus ved Fujian Agricultural and Forestry University (Fuzhou, Kina) i februar 2015 og vedligeholdt under regelmæssige vækstbetingelser for sukkerrør.
Et BAC-bibliotek blev konstrueret ud fra det haploide genom. af S. spontaneum AP85-441 (4x = 32), som blev afledt af S. spontaneum SES208 (2n = 8x = 64) via anther in vitro-kultur. Genomstørrelsen på AP85-441 er ca. 3,2 Gbp. Biblioteket bestod af 38.400 kloner med en gennemsnitlig insertstørrelse på 100 kb, der dækkede 6 × af hele genomet.Dette BAC-bibliotek er blevet brugt til at identificere saccharosetransportører og fructokinase-genfamilier i S. spontaneum (Zhang et al., 2016; Chen et al., 2017).
Screening af BAC-biblioteket
35.156 BAC-kloner fra AP85-441-bibliotekerne blev samlet i 701 biblioteker. Hvert bibliotek indeholder et gennemsnit på 50 BAC-kloner. DNA-bibliotekerne blev forberedt med PhasePrepTM BAC DNA Kit (Sigma, USA) efter producentens protokoller. BAC-DNA-biblioteker blev sekventeret ved hjælp af Illumina HiSeq 2500-platform med PE250-model. I alt 686 biblioteker (18 biblioteker mislykkedes til sekventering) blev sekventeret, og 267,5 Gb renset data blev genereret efter trimning ved hjælp af Trimmomatic version 0.36 (Bankevich et al., 2012). Data fra hver BAC-pool blev samlet ved hjælp af SPAdes version 3.09 med standardparameter. I alt 2.611.145 contigs blev samlet med contig N50 på 7.38 kbp (Zhang og Ming, upubliserede data).
AP85-441 BAC-bibliotekssekvenserne blev BLAST-søgt mod sorghumgenomet med en E-værdi på 1e -4. Sekvenserne, der havde enkelte BLAST-hits i sorghumgenomet, blev valgt som kandidat-FISH-prober. For at identificere BAC-kloner med lavt kopiantal fra BAC-biblioteket blev sekvensspecifikke primere designet med Primer 5.0-software til at muliggøre screening af BAC-pools specifikt ved PCR. Primerlængder på 18-25 bp, Tm-værdier på 55-65 ° C og nukleotidsammensætninger på 40-60% cytosin og guanin blev valgt. En totrins PCR-metode blev anvendt til at screene 3D-dimensionerne i BAC-biblioteket (Asakawa et al., 1997; Crooijmans et al., 2000) med nogle ændringer. Hver klon fra en 384-brønds plade blev dyrket i 80 pi Lysogeny bouillon + 34 mg / ml chloramphenicol natten over ved 37 ° C i en 384-brønds kulturplade. I alt blev otte 384-brønds plader med i alt 3072 BAC-kloner dyrket. For hver plade med 384 brønde konstruerede vi først 16 række puljer (række A til P) og 24 kolonne puljer (kolonne 1–24) til hver 384-brønds plade ved at blande lige store mængder kultur af hver enkelt klon og blandede derefter 16 række puljer og 24 kolonne puljer sammen med lige store volumener fra hver række og kolonne pool som en pladepool eller superpool. I denne undersøgelse fokuserede vi på screening af otte 384-brønds plader. Således blev otte superpools forberedt separat for de otte plader. Den positive 384-brønds plade fra de otte plader blev identificeret, og derefter blev den positive række blandt de 16 blandinger screenet. Endelig blev de PCR-positive søjler valgt blandt 24 søjleblandinger. Fireogtyve PCR-reaktioner blev udført for at identificere positive kloner fra de otte 384-brøndsplader.
PCR-amplifikationer blev udført som tidligere beskrevet (Bouzidi et al., 2006). Hver reaktion omfattede rTaq forblanding 7,5 pi, 0,6 pi af hver primer (10 pM), 1,0 pi bakterievæske skabelon til et slutvolumen på 20 pi. Efter indledende denaturering ved 95 ° C i 5 minutter blev der udført 35 cykler ved 95 ° C i 30 s, 55 ° C i 30 s og 72 ° C i 1 min. PCR-produkter blev analyseret på en 1,5% agarosegel.
Metaphase-kromosompræparation
Kromosompræparation blev udført som tidligere beskrevet (Lou et al., 2010) med mindre modifikationer. Kort sagt blev S. spontaneum-planter dyrket under drivhusforholdene til høst af rodspidser. Udskårne rodspidser ca. 1–2 cm blev behandlet med 0,002 mol / l 8-hydroxyquinolin ved stuetemperatur i 2-4 timer, skyllet i vand i 15 minutter og fikseret i ethanol: eddikesyre (3: 1) i mindst 24 h ved stuetemperatur. Rotspidserne blev derefter fordøjet i en enzymopløsning (4% cellulose R-10 og 2% pectolyase i 0,1 M citratbuffer) ved 37 ° C i 1 time, vasket med isdeioniseret vand i 30 minutter og endelig inkuberet i ethanol: eddikesyre (3: 1) i ca. 30 minutter. Objektglassene blev fremstillet ifølge “flammetørret” -metoden (Iovene et al., 2008).
BAC DNA-oprensning og probemærkning
BAC-DNA blev ekstraheret med PhasePrepTM BAC DNA-kit ifølge producentens manual. Oprenset BAC-DNA blev mærket ved standard nick-translation-reaktion, inklusive fortyndet DNase I, 10 × nick-translation-buffer, DNA-polymerase I, dNTP’er, biotin- / digoxigenin-mærkede dUTP’er og BAC-DNA. blev inkuberet ved 15 ° C i 1,5 h. De udskårne produkter blev derefter undersøgt på en 1,5% agarosegel for tilstedeværelse af et udstrygning mellem 300 og 500 bp. De opnåede prober blev opbevaret ved -20 ° C, indtil de blev anvendt.
In situ-hybridisering og påvisning
Probenblanding og hybridisering: Først probe-blandingen (50% deioniseret formamid, 2 × SSC, 80 ng digoxygenin- / biotin-mærket DNA, 10% dextransulfat , > 1 ug C ° t-100) blev anbragt i en 90 ° C varm blok i 5 minutter og derefter straks overført på is, indtil den var klar til sonde for hybridizati på. De tidligere fremstillede flammetørrede objektglas blev behandlet med 70% deioniseret formamid, denatureret på en varmeblok ved 80 ° C i 1.5 minutter, straks nedsænket sekventielt i iskold 70% ethanol, 90% ethanol og derefter 100% ethanol hver i 5 minutter og derefter lufttørret på bænken. Endelig blev denaturerede sonder tilføjet til hvert objektglas og dækket med 24 × 32 mm dækglas. Objektglassene blev anbragt i et fugtigt kammer ved 37 ° C natten over.
Probedetektion: dækglasene blev fjernet, og objektglassene blev vasket ved stuetemperatur i 2 x SSC i 5 minutter ved 42 ° C i 2 x SSC i 10 minutter og ved stuetemperatur i 1 × PBS i 5 minutter i denne sekvens. Biotin-mærkede probesignaler blev påvist med 2 mg / ml Alexa Fluor 488 streptavidin, og digoxygenin-mærkede probesignaler blev påvist med 2% anti-digoxigenin-rhodamin fra får. Antistofcocktailen (100 pi TNB-puffer, 1 pi Alexa Fluor 488 streptavidin, 1 pi rhodamin-anti-dig-får) blev tilsat til objektglasene, som var dækket med 24 × 32 mm dækglas, inkuberet i 1 time ved 37 ° C i et fugtigt kammer og vasket ved stuetemperatur i 1 × PBS tre gange i 5 minutter hver. Overskydende væske blev fjernet, og 4 ‘, 6-diamidino-2-phenylindol (DAPI) (Sigma, St. Louis, MO, USA) i antifadeopløsningen Vectashield (Vector, Burlingame, CA, USA) blev tilsat for at modfarve kromosomer. Billeder blev taget med et Olympus BX63 epifluorescensmikroskop. FISH-signalbilleder blev analyseret ved hjælp af CellSens Dimension-softwaren.
Resultater
Screening BAC-kloner med lav kopi
For at screene BAC-kloner, der potentielt har et lavt kopiantal sekvenser i S. spontaneum genomet, vi BLAST søgte de sekventerede AP85-441 BAC biblioteker mod sorghum genomet. I alt 2000 BAC-sekvenser svarende til 10 sorghum-kromosomer med god kollinearitet og viser sekvensspecificitet blev screenet. AP85-441 BAC-sekvenserne fra 2000 blev maskeret af REPEATMASKER mod den gentagne sorghum-DNA-database og TIGR gramineae-databasen for at filtrere gentagne sekvenser. Endelig blev 114 BAC’er fordelt på 10 sorghumkromosomer valgt til FISH-analyse (supplerende tabel 1) med 7-16 BAC’er på hver af de 10 sorghumkromosomer (figur 1). For at screene positive BAC-kloner blev der konstrueret 114 specifikke primere baseret på BAC-klonsekvenserne (supplerende tabel 2), og 49 positive BAC-kloner blev screenet fra BAC-bibliotekerne (supplerende tabel 3).
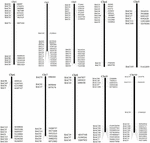
FIGUR 1. Fordelingerne af 114 BAC-kloner fra AP85-441 i sorghums kromosomer. BAC1-114 repræsenterer BAC-nummeret, dataene til højre er den fysiske placering af BAC i den tilsvarende region af sorghum-kromosomerne. Enhed = bp.
BAC-FISH Signalstyrke og distribution
DNA-prøver isoleret fra de 49 positive BAC-kloner blev mærket med biotin eller digoxigenin. 5S rDNA- og 45S rDNA-prober blev brugt som kontrol og blev hybridiseret til S. spontaneum somatiske metafase-kromosomer efter FISH-proceduren. På grund af sammenhængen mellem signalstyrke og variationen af gentagne sekvensindhold i BAC-sekvenserne brugte vi C ° t-100 som en konkurrent (tabel 1). BAC-kloner, der viser stærke og stabile hybridiseringssignaler, blev valgt til yderligere FISH-analyse.

TABEL 1. Klassificeringen af 27 positive kloner med blokerende DNA.
I alt 64 forskellige kromosomer kan observeres i metafasen af S. spontaneum. Hver BAC-FISH blev udført i fire uafhængige eksperimenter (eller dias). Mindst 10 spredninger af somatiske metafasekromosomer blev analyseret i hvert objektglas. Resultaterne viste, at de 27 specifikke sonder (supplerende tabel 4) kan klassificeres i fem grupper baseret på hybridiseringssignalet (tabel 1). I gruppe I (inklusive BAC-18, BAC-20, BAC-29 og BAC-84) viste prober otte karakteristiske steder uden konkurrencedygtig in situ-undertrykkelse (CISS) ved anvendelse af C ° t-100 (figur 2A), hvilket tyder på få gentagne sekvenser eksisterede i disse BAC-sekvenser. I gruppe II (inklusive BAC-2, BAC-11, BAC-14, BAC-19, BAC-31, BAC-33, BAC-43, BAC-71, BAC-73 og BAC-74), ° C -100 blev brugt som konkurrent til BAC-probehybridisering, og seks til syv ret forskellige steder blev vist i karyotyper af denne gruppe (figur 2B). Hybridiseringsresultatet svarede til 45S rDNA med syv signalsteder, som kan være forårsaget af kromosomstrukturvariation i det homologe kromosom. I gruppe III (inklusive BAC-26, BAC-66, BAC-76 og BAC-78) blev C ° t-100 DNA anvendt som en konkurrent, og otte forskellige steder kunne observeres i karyotypen, hvilket antyder denne gruppe af BAC kloner har gentagne DNA-sekvenser (figur 2C). I gruppe IV (inklusive BAC-24) blev der observeret mere end otte signalsteder i karyotypen og dukkede op i de pericentromere og telomere regioner (figur 2D), hvilket tyder på, at disse BAC-prober havde gentagne sekvenser i S. spontaneum.I gruppe V (inklusive BAC-4, BAC-5, BAC-32, BAC-34, BAC-35, BAC-69, BAC-77 og BAC-81) viste proberne spredte signaler i alle kromosomer med begrænsede regioner af individuelle kromosomer, der viser specifikke signaler (figur 2E). Hybridiseringsresultatet viste, at denne gruppe af BAC-kloner indeholdt store mængder gentagne DNA i S. spontaneum, hvilket kan være forårsaget af en hurtig evolutionær divergens for de gentagne regioner efter opdeling af sorghum og S. spontaneum. Derfor viste et sæt på 19 BAC-sonder (supplerende tabel 3) fra gruppe I, II og III specifikke signaler på S. spontaneum-kromosomer svarende til ni af sorghum-kromosomerne ved siden af Sb05 af de 49 BAC-prober. Signalerne fra de øvrige 22 sonder blev spredt i alle kromosomer. Vi valgte et sæt på 19 BAC-prober som S. spontaneum-kromosomspecifikke signaler (figur 3). Af de 19 BAC-prober var en probe placeret på Sb02, Sb04 og Sb09; to sonder på Sb07, Sb08 og Sb10; tre sonder på Sb01 og Sb06; og fire sonder på Sb03. Dette sondesæt tilvejebragte et nyttigt værktøj til komparativ analyse af S. spontaneum og sorghum (tabel 2).
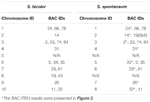
TABEL 2. Fordelingen af BAC-FISH-prober i kromosomer af S. bicolor og S. spontaneum.
Konstruktion af et BAC-bibliotek, der er specifikt for S. spontaneum-kromosomer
Sb01 og Sb02 er de to største sorghum-kromosomer. For at detektere genom-syntenen mellem sorghum og S. spontaneum blev 10 kromosomspecifikke BAC-kloner valgt fra gruppe I, II og III. Af disse 10 BAC-prober var tre prober (BAC-klon-ID: 24, 66, 78) homologe med Sb01, og syv prober (BAC-klon-ID: 14, 18, 20, 69, 71, 73, 77) svarede til Sb02. Vi udnyttede dobbeltfarvedetektion af FISH til komplementært mærkede BAC-par og proberne til kortlægning af det kædecytogenetiske forhold for BAC-klonerne. Ved at gøre dette konstruerede vi det cytogenetiske kort over S. spontaneum baseret på de 10 BAC-prober.
For tre prober svarende til Sb01 viste FISH-analyse af S. spontaneum (SES208), at BAC-24 og BAC -78 prober var hovedsageligt placeret på den distale region af S. spontaneum-kromosom 1, og BAC-66 blev kortlagt i nærheden af det centromere område (figur 4). BAC-24 og BAC-66 lokaliseret til det samme kromosom (S. spontaneum kromosom 1); samtidig hvor probe 66 og probe 78 også befinder sig på det samme kromosom, hvilket viser, at de tre BAC-prober distribueres til de samme kromosomer i S. spontaneum, hvilket antyder syntese mellem S. spontaneum og sorghum for kromosom 1. FISK-resultater afslørede, at de syv BAC-prober justeret til Sb02; kun sonder 69, 71, 73 og 77 af de syv BAC’er genererede intense signaler på et S. spontaneum-kromosom (SsChr2) (figur 5); mens sonder 14, 18 og 20 ikke kunne detekteres på S. spontaneum kromosom 2, men blev observeret på andre S. spontaneum kromosomer. Disse resultater viste, at kromosomomlejringerne forekom i den tilsvarende Sb02 mellem S. spontaneum og sorghum.
Desuden delte sekvensen af BAC-2 høj lighed (97%) med et fragment på kromosom 3 af sorghum. Dobbeltfarvet FISH-analyse viste, at både BAC-2 og 45s rDNA blev kortlagt til den samme placering af S. spontaneum-kromosomet (figur 6).
Kromosomomlejring på Sb02 mellem Sorghum og S. spontaneum
For yderligere at undersøge kromosomomlægningen på Sb02 mellem sorghum og S. spontaneum, kromosom -specifikke prober svarende til Sb02 (BAC-14, BAC-18 og BAC-20) og svarende til Sb08 (BAC-19 og BAC-43) blev anvendt til FISH-analyse. Resultaterne viste, at BAC-14 og BAC-19 blev kortlagt til forskellige arme af de samme S. spontaneum-kromosomer, hvilket indikerer, at kromosomomlejringer fandt sted mellem kromosomer 2 og 8 i S. spontaneum og sorghum (figur 7).
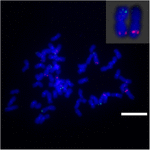
FIGUR 7. Omlejring af kromosom i sukkerrør og sorghum som afsløret af FISH. BAC-14 og BAC-19 sonder mærket med biotin (grøn) og digoxigenin (rød). Skalestænger = 10 μm.
Diskussion
Saccharum er en kompleks slægt karakteriseret ved høje polyploidieniveauer, med små kromosomer (Ha et al., 1999; Dhont, 2005). At skelne individuelle Saccharum-kromosomer ud fra deres morfologi er meget udfordrende. Ved at udnytte sekvenser, der er stærkt dækket af BAC-biblioteket i S. spontaneum, var vi i stand til at screene for de potentielle lave kopiantal BAC-kloner i S. spontaneum ved hjælp af sorghumgenomet som reference. Som en høj polyploid art kan S. spontaneum indeholde flere genomomlægninger end diploider.Forskellene i genomerne mellem S. spontaneum og sorghum kan være årsagen til unøjagtighed i forudsigelserne af de lave BAC-sekvenser i S. spontaneum-genomet. I denne undersøgelse har vi oprindeligt opnået 114 potentielle BAC-sekvenser med enkeltkopi baseret på sorghumgenomet. Imidlertid kunne kun 49 identificeres i de delvise BAC-biblioteker, og 27 viste sig at være kromosomspecifikke BAC-FISH-prober. Der er mindst to grunde til at forklare disse resultater. For det første var de 114 BAC-sekvenser delvise fragmenter af BAC-insertionen på grund af begrænsningerne ved NGS-sekvenssamling og kan indeholde gentagne sekvenser i de andre regioner, der ikke har nogen sekvensinformation. Disse potentielt afdækkede gentagelsessekvenser kan vildlede påvisningen af sekvenser med lav kopi gennem sekvenssammenligning. For det andet kan den nylige polyploidisering i S. spontaneum forårsage variationen af gentagne sekvenser mellem S. spontaneum og sorghum og således resultere i det uspecifikke FISH-signal i S. spontaneum. I en tidligere undersøgelse genererede sekventering af 20 BAC’er i sukkerrørshybrider 1,45 Mb contig-sekvenser, sekvenserne på linje med sorghumgenom spændte 0,99 Mb, hvilket tegnede sig for ca. halvdelen af sukkerrørets BAC-sekvenser (Wang et al., 2010). Der eksisterede naturligvis sletninger / indsættelser mellem sorghum og Saccharum, og udnyttelsen af sorghumgenomet som reference kan ikke erstatte de unikke egenskaber ved Saccharum-genomet og kan derfor forårsage uforudsete FISH-resultater.
Nogle FISH-objektglas havde stærke baggrundsstøj, som kan skyldes små regioner med gentagne sekvenser (såsom SSR-sekvenser) i BAC-klonen, som følgelig producerer interferens under hybridisering. Sorghumgenomet har et gentaget indhold på ca. 61% (Paterson et al., 2009), mens ca. halvdelen af genomet er sammensat af gentagne sekvenser i Saccarrum-hybrider (De et al., 2014). I disse gentagne rige genomer er det vanskeligt at udvikle signal-specifikke FISH-sonder, der adskiller kromosomer cytogenetisk med lignende morfologier. CISS med blokerende DNA C ° t-100 kan effektivt udelukke gentagne sekvenser. I denne undersøgelse blev blokerende DNA C ° t-100 anvendt til FISH-analyse af BAC-proberne i gruppe II og III (figur 2D-F), som blev verificeret til at være de kromosomspecifikke BAC-prober, mens FISH af BAC-prober i gruppe IV og V producerede stærk baggrundsinterferens (figur 2D – F). Det er indlysende, at der er variationer af gentagne sekvenser blandt de undersøgte BAC-prober. Derfor ville optimering af eksperimenter være nødvendig for BAC-FISH-analyse i Saccharum. Seks til syv steder blev vist i gruppe II, hvilket kunne være forårsaget af de homologe kromosomstrukturvariationer, såsom fragmentets sletning i en eller to homologe kromosomer. I hexaploid hvede hybridiserede BAC 676D4 stærkere til A-genom-kromosomerne end til B- og D-genom-kromosomerne (Zhang et al., 2004). Disse ikke-detekterbare af et til to signaler i de homologe kromosomer kunne også være forårsaget af de tekniske problemer med BAC-FISH for så mange kromosomer med lille størrelse.
I denne undersøgelse identificerede vi 27 kromosomspecifikke BAC- FISK-sonder, der svarer til 9 af de 10 sorghum-kromosomer (alle undtagen Sb05). I en undersøgelse af det genetiske kort afledt af en krydsning mellem S. officinarum og sukkerrørsorter blev Sb05 fusioneret med Sb06 i sukkerrør (Aitken et al., 2014). I vores undersøgelse afslørede et genetisk kort baseret på F1-populationen i S. spontaneum, at Sb05 blev opdelt i to segmenter, og de to segmenter blev fusioneret med henholdsvis Sb06 og Sb07 (Zhang og Ming, upublicerede data). For nylig viste det genetiske kort over et medlem af Andropogoneae, Miscanthus sinensis, at Sb05 har dårlig kollinearitet med den tilsvarende koblingsgruppe i M. sinensis (Ma et al., 2012). Tilsvarende beholder de to forfædre majskromosomer, der er ortologe til Sb05, det mindste antal synteniske ortologer til sorghumgener (Schubert og Lysak, 2011). Derfor kan fraværet af BAC-FISH svarende til Sb05 indikere kromosomfusion i S. spontaneum.
Sorghum og S. spontaneum divergerede for 12 millioner år siden (MYA), det grundlæggende kromosontal blev reduceret fra x = 10 til x = 8. I Aitken et al. (2014), HG2 (homolog gruppe 2) af sukkerrør justeret til Sb05 og Sb06 og HG8 (homolog gruppe 8) til Sb02 og Sb08, hvilket giver bevis for den grundlæggende kromosomreduktionshændelse (Aitken et al., 2014). I denne undersøgelse observerede vi, at sorghum-kromosomerne Sb02 og Sb08 havde interkromosomal omlejring i S. spontaneum som demonstreret af beviset for, at BAC-14 var tilpasset Sb02, og BAC-19 justeret til Sb08 (figur 7). Vores undersøgelse leverede det første fysiske og cytogenetiske bevis for sorghum inter-kromosom omlejring i S. spontaneum. Ikke-offentliggjorte data fra vores gruppe afslørede også, at Sb08 er opdelt i to segmenter og blev fusioneret med af henholdsvis Sb02 og Sb09 i henholdsvis S. spontaneum (Zhang og Ming, ikke-offentliggjorte data).Proberne svarende til Sb09, Sb08, Sb05 og Sb06 kunne yderligere bruges til at undersøge de interkromosomale hændelser mellem sorghum og S. spontaneum. S. spontaneum har en bred vifte af ploidiniveauer (2n = 40-128) (Irvine, 1999). Disse BAC-prober kunne bruges til at bekræfte den interkromosomale omlejring af S. spontaneum med de forskellige polyploidiniveauer.
På grund af forskellige grundlæggende kromosomantal mellem sorghum (x = 10) og S. spontaneum (x = 8) var sorghumkromosomerne ikke en en-til-en korrespondance med S. spontaneum. Som vores genetiske kortlægningsundersøgelse nævnt heri før, blev Sb08 opdelt i to segmenter, der flettede med segmenter af Sb02 og segmenter af Sb09 i S. spontaneum; Sb05 blev opdelt i to segmenter, der flettede med segmenter af Sb06 og segmenter af Sb07 S. spontaneum. Derfor var proberne, der svarede til Sb08 og Sb05, ikke specifikke for enkelt S. spontaneum-kromosomer, mens de andre prober, der svarer til de andre otte sorghum-kromosomer, kan bruges som kromosomspecifikke cytogenetiske BAC-FISH-prober for S. spontaneum. De testede BAC-prober var således baseret på de otte sorghumkromosomer (tabel 2) var tilstrækkelige til kromosomidentifikation ved anvendelse af BAC-FISH. Et satellitkromosom blev fundet i et S. spontaneum-kromosom (kromosom 3) (Ha et al., 1999). Tidligere afslørede samtidig FISH, at signalerne fra 45S rDNA var placeret på de sekundære indsnævringer af satellitkromosomerne i kromosomet 3 fra den anther-kultur-afledte S. spontaneum-klon (AP85-361) (Ha et al., 1999). I denne undersøgelse blev BAC-2, der svarer til Sb03 og 45s rDNA, kortlagt til den samme placering af S. spontaneum-kromosomet, hvilket yderligere understøtter tidligere fund (Ha et al., 1999). Vores resultater leverede også direkte bevis for, at kromosom 3 af S. spontaneum navngivet i den foregående undersøgelse er homologt med Sb03.
Konklusion
I denne undersøgelse udviklede vi kromosomspecifikke BAC’er af S spontaneum som et skridt mod udviklingen af en enkel og reproducerbar metode til kromosomidentifikation ved anvendelse af BAC-FISH cytogenetiske markører, der bekræfter muligheden for at isolere kromosomspecifikke BAC’er baseret på sorghumgenomet til at konstruere et fysisk kort over sukkerrør. Vi leverer også det første cytogenetiske bevis for interkromosomal omlejring mellem sorghum og S. spontaneum. Oprettelsen af sukkerrør BAC-FISH-teknologisystemet giver nye muligheder og midlerne til sukkerrørsmolekylær cytogenetikforskning, herunder karyotype-analyse, genlokalisering og fysisk kortkonstruktion. Disse resultater er afgørende for samling af S. spontaneum-genom, der kræves til helgen-sekventering.
Forfatterbidrag
GD, JS og JZ udtænkt undersøgelsen og designet eksperimenterne. GD, JS, QZ, JW, QY, RM, KW og JZ udførte eksperimenterne og analyserede dataene. GD og JZ skrev manuskriptet. Alle forfattere læste og godkendte det endelige papir.
Finansiering
Dette projekt blev støttet af tilskud fra 863-programmet (2013AA102604), NSFC (31201260), Program for nye århundredes fremragende talenter i Fujian Province University og finansieringen fra Fujian Agriculture and Forestry University.
Erklæring om interessekonflikter
Forfatterne erklærer, at forskningen blev udført i fravær af kommercielle eller økonomiske forhold der kunne fortolkes som en potentiel interessekonflikt.
Anerkendelser
Vi takker Dr. Xintan Zhang for at samle BAC-sekvenserne og Dr. Irene Lavagi for redigering af engelsk.
Supplerende materiale
Dhont, A. (2005). Afvikling af genomstrukturen af polyploider ved hjælp af FISH og GISH; eksempler på sukkerrør og banan. Cytogenet. Genome Res. 109, 27–33. doi: 10.1159 / 000082378
PubMed Abstract | CrossRef fuldtekst | Google Scholar
Piperidis, G., D’Hont, A. og Hogarth, D. M. (2001). “Kromosomsammensætningsanalyse af forskellige Saccharum interspecifikke hybrider ved genomisk in situ (hybridisering) (GISH)” i Proceedings of the International Society of Sugar Cane Technologists, XXIV Congress (Brisbane, QLD: ASSCT), 565-566.
Google Scholar
