Charles ’s Law
De Franse natuurkundige Jacques Charles (1746 – 1823) bestudeerde het effect van temperatuur op het volume van een gas bij constante druk. De wet van Charles stelt dat het volume van een gegeven gasmassa direct varieert met de absolute temperatuur van het gas wanneer de druk constant wordt gehouden. De absolute temperatuur is de temperatuur gemeten met de Kelvin-schaal. De Kelvin-schaal moet worden gebruikt omdat nul op de Kelvin-schaal overeenkomt met een volledige stopzetting van de moleculaire beweging.
Wiskundig gezien kan de directe relatie van de wet van Charles worden weergegeven door de volgende vergelijking:
\
Net als bij de wet van Boyle, is \ (k \) alleen constant voor een bepaald gasmonster. De onderstaande tabel toont temperatuur- en volumegegevens voor een ingestelde hoeveelheid gas bij een constante druk. De derde kolom is de constante voor deze specifieke gegevensset en is altijd gelijk aan het volume gedeeld door de Kelvin-temperatuur.
Wanneer deze gegevens in een grafiek worden weergegeven, is het resultaat een rechte lijn, wat duidt op een directe relatie, weergegeven in de onderstaande afbeelding.
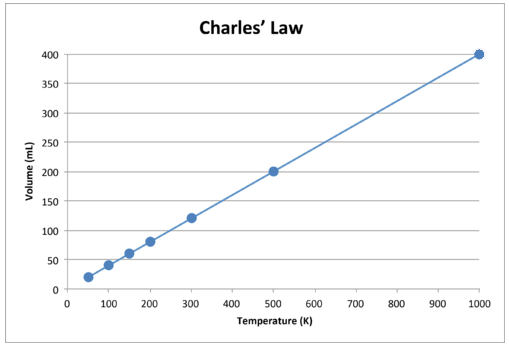
Figuur \ (\ PageIndex {2} \): Het volume van een gas neemt toe naarmate de Kelvin-temperatuur stijgt.
Merk op dat de lijn precies naar de oorsprong gaat, wat betekent dat als de absolute temperatuur van het gas nul nadert, het volume nul nadert. Wanneer een gas echter op extreem lage temperaturen wordt gebracht, zouden de moleculen ervan uiteindelijk condenseren tot de vloeibare toestand voordat ze het absolute nulpunt bereiken. De temperatuur waarbij deze overgang naar de vloeibare toestand plaatsvindt, varieert voor verschillende gassen.
\
Deze vergelijking kan worden gebruikt om een van de vier grootheden te berekenen als de andere drie bekend zijn . De directe relatie is alleen geldig als de temperaturen worden uitgedrukt in Kelvin. Temperaturen in graden Celsius zullen niet werken. Herinner de relatie die \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
