シャルルの法則
フランスの物理学者ジャック・シャルル(1746-1823)は温度の影響を研究しました一定圧力でのガスの体積について。シャルルの法則は、圧力が一定に保たれている場合、ガスの特定の質量の体積はガスの絶対温度によって直接変化すると述べています。絶対温度はケルビンスケールで測定された温度です。ケルビンスケールのゼロは分子運動の完全な停止に対応するため、ケルビンスケールを使用する必要があります。
数学的には、シャルルの法則の直接的な関係は次の方程式で表すことができます。
\
ボイルの法則と同様に、\(k \)は特定のガスサンプルに対してのみ一定です。下の表は、一定圧力で設定された量のガスの温度と体積のデータを示しています。 3番目の列は、この特定のデータセットの定数であり、常に体積をケルビン温度で割った値に等しくなります。
このデータをグラフ化すると、結果は直線になり、直接的な関係を示します。下の図に示されています。
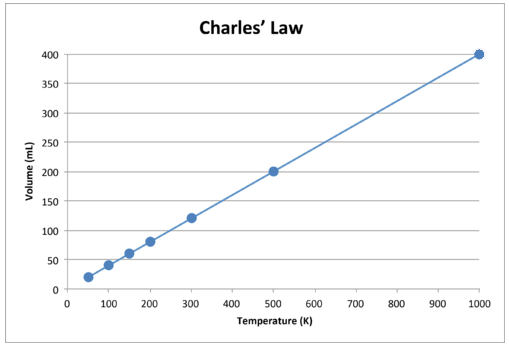
図\(\ PageIndex {2} \):ガスの量は次のように増加します。ケルビン温度が上昇します。
線が正確に原点に向かっていることに注意してください。つまり、ガスの絶対温度がゼロに近づくと、その体積はゼロに近づきます。ただし、ガスが極端に低温になると、その分子は最終的に凝縮して液体状態になり、絶対零度に達します。この液体状態への変化が発生する温度は、ガスによって異なります。
\
この式を使用して、他の3つがわかっている場合は、4つの量のいずれかを計算できます。 。直接的な関係は、温度がケルビンで表されている場合にのみ成立します。摂氏の温度は機能しません。 \(\ text {K} = \:^ \ text {o} \ text {C} + 273 \)という関係を思い出してください。
