Forbedringen af søgeudtrykket foretages under en forsøgssøgning og på udkig efter et andet relevant udtryk inden for hvert koncept fra hentede papirer. For at søge efter et klinisk forsøg kan vi bruge disse deskriptorer i PubMed: “klinisk forsøg” ELLER “kliniske forsøg som emne” ELLER “klinisk forsøg”. Efter nogle forsøgsrunder og forfining af søgeudtryk formulerer vi det endelige søgeudtryk for PubMed som følger: (ebola ELLER ebolavirus ELLER ebolavirus sygdom ELLER EVD) OG (vaccine ELLER vaccination ELLER vaccineret ELLER immunisering) OG (“klinisk forsøg” ELLER “kliniske forsøg som emne” ELLER “klinisk forsøg”). Da undersøgelsen for dette emne er begrænset, inkluderer vi ikke resultatudtryk (sikkerhed og immunogenicitet) i søgeudtrykket for at opfange flere undersøgelser.
Søg i databaser, importer alle resultater til et bibliotek og eksporter til et excel-ark
I henhold til AMSTAR-retningslinjerne skal der søges i mindst to databaser i SR / MA, men når du øger antallet af søgte databaser, får du meget udbytte og mere nøjagtige og omfattende resultater. Bestillingen af databaser afhænger hovedsageligt af gennemgangsspørgsmålene; Når du er i en undersøgelse af kliniske forsøg, vil du hovedsagelig stole på Cochrane, mRCT’er eller International Clinical Trials Registry Platform (ICTRP). Her foreslår vi 12 databaser (PubMed, Scopus, Web of Science, EMBASE, GHL, VHL, Cochrane, Google Scholar, Clinical studier.gov, mRCTs, POPLINE og SIGLE), som hjælper med at dække næsten alle publicerede artikler inden for tropisk medicin og andre sundhedsrelaterede områder. Blandt disse databaser fokuserer POPLINE på reproduktiv sundhed. Forskere bør overveje at vælge relevant database i henhold til forskningsemnet. Nogle databaser understøtter ikke brugen af boolsk eller citat; Ellers er der nogle databaser, der har en særlig søgemåde. Derfor er vi nødt til at ændre de oprindelige søgetermer for hver database for at få værdsatte resultater; derfor præsenteres manipulationsvejledninger for hver online databasesøgning i yderligere fil 5: tabel S2. Den detaljerede søgestrategi for hver database findes i yderligere fil 5: tabel S3. Søgeudtrykket, som vi oprettede i PubMed, har brug for tilpasning baseret på et specifikt kendetegn ved databasen. Et eksempel på Google Scholar avanceret søgning efter vores emne er som følger:
-
Med alle ordene: ebolavirus
Med mindst et af ordene: vaccine vaccination vaccineret vaccination
Hvor mine ord forekommer: i artiklens titel
-
Med alle ordene: EVD
Med mindst et af ordene: vaccine vaccineret vaccineret immunisering
Hvor mine ord forekommer: i titlen på artiklen
Endelig er alle poster indsamlet i et Endnote-bibliotek for at slette dubletter og derefter eksportere til et excel-ark. Brug af duplikeringsfunktion med to muligheder er obligatorisk. Alle referencer, der har (1) samme titel og forfatter, og offentliggjort i samme år, og (2) samme titel og forfatter og offentliggjort i samme tidsskrift, vil blive slettet. Referencer, der er tilbage efter dette trin, skal eksporteres til en excel-fil med vigtige oplysninger til screening. Disse kunne være forfatterens navne, udgivelsesår, tidsskrift, DOI, URL-link og abstrakt.
Protokolskrivning og -registrering
Protokolregistrering på et tidligt tidspunkt garanterer gennemsigtighed i forskningen behandler og beskytter mod dobbeltproblemer. Desuden betragtes det som et dokumenteret bevis for holdets handlingsplan, forskningsspørgsmål, kriterier for støtteberettigelse, intervention / eksponering, kvalitetsvurdering og plan for analyse. Det anbefales, at forskere sender det til den primære efterforsker (PI) for at revidere det og derefter uploader det til registreringsdatabase-websteder. Der er mange registreringsdatabase-sider tilgængelige for SR / MA som dem, der er foreslået af Cochrane og Campbell-samarbejder; Vi anbefaler dog at registrere protokollen i PROSPERO, da det er lettere. Layoutet af en protokolskabelon, ifølge PROSPERO, kan findes i yderligere fil 5: Fil S1.
Titel og abstrakt screening
Beslutninger om at vælge hentede artikler til yderligere vurdering er baseret om kriterier for berettigelse for at minimere chancen for at inkludere ikke-relevante artikler. Ifølge Cochrane-vejledningen er to korrekturlæsere et must for at gøre dette skridt, men hvad angår begyndere og juniorforskere, kan dette være trættende; Derfor foreslår vi på baggrund af vores erfaring, at mindst tre korrekturlæsere skal arbejde uafhængigt for at reducere risikoen for fejl, især i teams med et stort antal forfattere for at tilføje mere kontrol og sikre korrekt adfærd.For det meste ville kvaliteten med tre korrekturlæsere være bedre end to, da to kun ville have forskellige meninger fra hinanden, så de ikke kan afgøre, mens den tredje mening er afgørende. Og her er nogle eksempler på systematiske gennemgange, som vi gennemførte efter samme strategi (af en anden gruppe forskere i vores forskningsgruppe) og offentliggjorde med succes, og de indeholder relevante ideer til tropisk medicin og sygdom.
I dette trin fjernes duplikationer manuelt, når korrekturlæserne finder ud af dem. Når der er tvivl om en artikelbeslutning, skal holdet være inkluderende snarere end eksklusivt, indtil hovedlederen eller PI træffer en beslutning efter diskussion og konsensus. Alle ekskluderede poster skal gives grunde til udelukkelse.
Download og screening i fuld tekst
Mange søgemaskiner giver gratis links til at få adgang til artikler i fuldtekst. Hvis det ikke findes, kan vi søge på nogle forskningswebsteder som ResearchGate, som tilbyder en mulighed for direkte anmodning om fuldtekst fra forfattere. Derudover udforske arkiver med eftersøgte tidsskrifter eller kontakte PI for at købe det, hvis det er tilgængeligt. På samme måde arbejder 2-3 korrekturlæsere uafhængigt for at beslutte om inkluderede fulde tekster i henhold til kvalificeringskriterier med rapporteringsekskludering af artikler. I tilfælde af uenighed skal den endelige beslutning træffes ved diskussion.
Manuel søgning
Man skal udtømme alle muligheder for at reducere bias ved at udføre en eksplicit håndsøgning efter hentning af rapporter, der muligvis er blevet droppet fra den første søgning. Vi anvender fem metoder til at foretage manuel søgning: søgning i referencer fra inkluderede studier / anmeldelser, kontakt til forfattere og eksperter og se på relaterede artikler / citerede artikler i PubMed og Google Scholar.
Vi beskriver her tre på hinanden følgende metoder til øge og forfine udbyttet af manuel søgning: for det første at søge i referencelister over inkluderede artikler; for det andet at udføre såkaldt citationssporing, hvor korrekturlæserne sporer alle de artikler, der citerer hver af de inkluderede artikler, og dette kan involvere elektronisk søgning i databaser; og for det tredje, i lighed med citationssporing, følger vi alle “relaterede til” eller “lignende” artikler. Hver af de ovennævnte metoder kan udføres af 2-3 uafhængige korrekturlæsere, og alle de mulige relevante artikler skal gennemgås yderligere over for inklusionskriterierne efter at have fulgt de samme optegnelser fra elektroniske databaser, dvs. titel / abstrakt og fuldtekstscreening .
Vi foreslår en uafhængig gennemgang ved at tildele hvert medlem af holdene et “tag” og en særskilt metode til at kompilere alle resultaterne til sidst til sammenligning af forskelle og diskussion og maksimere hentning og minimering På samme måde skal antallet af inkluderede artikler angives før tilføjelse til de samlede inkluderede poster.
Dataekstraktion og kvalitetsvurdering
Dette trin berettiger dataindsamling fra inkluderet fuld- tekster i et struktureret ekstraktionsekselark, som tidligere er testet for ekstraktion ved hjælp af nogle tilfældige undersøgelser. Vi anbefaler at udtrække både justerede og ikke-justerede data, fordi det giver den mest tilladte forvirrende faktor til b brugt i analysen ved at samle dem senere. Udvindingsprocessen skal udføres af 2-3 uafhængige korrekturlæsere. For det meste klassificeres arket i undersøgelses- og patientkarakteristika, resultater og kvalitetsvurdering (QA) -værktøj.
Data, der præsenteres i grafer, skal ekstraheres af softwareværktøjer som f.eks. Digitalisering af webplot. De fleste af ligningerne, der kan bruges i ekstraktion før analyse og estimering af standardafvigelse (SD) fra andre variabler, findes i yderligere fil 5: Fil S2 med deres referencer som Hozo et al. , Xiang et al. og Rijkom et al. . En række forskellige værktøjer er tilgængelige til QA afhængigt af designet: ROB-2 Cochrane-værktøj til randomiserede kontrollerede forsøg, der præsenteres som yderligere fil 1: figur S1 og yderligere fil 2: figur S2 – fra tidligere offentliggjorte artikeldata—, NIH-værktøj til observations- og tværsnitsstudier, ROBINS-I-værktøj til ikke-randomiserede forsøg, QUADAS-2-værktøj til diagnostiske undersøgelser, QUIPS-værktøj til prognostiske studier, CARE-værktøj til caserapporter og ToxRtool til in vivo- og in vitro-studier. Vi anbefaler, at 2-3 korrekturlæsere uafhængigt vurderer kvaliteten af undersøgelserne og føjer til dataudvindingsformularen før de indgår i analysen for at reducere risikoen for bias. I NIH-værktøjet til observationsstudier – kohorte og tværsnit – som i dette EBOLA-tilfælde, for at evaluere risikoen for bias, skal korrekturlæsere bedømme hver af de 14 emner i dikotome variabler: ja, nej eller ikke relevant. En samlet score beregnes ved at tilføje alle elementernes score som ja er lig med en, mens nej og NA er lig med nul.Der gives en score for hvert papir for at klassificere dem som dårlige, retfærdige eller godt gennemførte studier, hvor en score fra 0–5 blev betragtet som dårlig, 6-9 som retfærdig og 10-14 som god.
I eksemplet ovenfor med EBOLA-sagen kan forfattere udtrække følgende oplysninger: navn på forfattere, patientland, publikationsår, undersøgelsesdesign (caserapport, kohortestudie eller klinisk forsøg eller RCT), stikprøvestørrelse, det inficerede punkt tid efter EBOLA-infektion, opfølgningsinterval efter vaccinationstid, effektivitet, sikkerhed, bivirkninger efter vaccinationer og QA-ark (yderligere fil 6: Data S1).
Datakontrol
På grund af den forventede menneskelige fejl og bias anbefaler vi et datakontroltrin, hvor hver inkluderet artikel sammenlignes med sin modstykke i et udvindingsark med bevisfotos for at opdage fejl i data. Vi anbefaler at tildele artikler til 2-3 uafhængige korrekturlæsere, ideelt set ikke dem, der udførte udtrækningen af disse artikler. Når ressourcerne er begrænsede, tildeles hver korrekturlæser en anden artikel end den, han udtog i det foregående trin.
Statistisk analyse
Efterforskere bruger forskellige metoder til at kombinere og sammenfatte resultaterne af inkluderede studier . Før analyse er der et vigtigt trin kaldet rengøring af data i ekstraktionsarket, hvor analytikeren organiserer ekstraktionsarkdata i en form, der kan læses af analytisk software. Analysen består af to typer, nemlig kvalitativ og kvantitativ analyse. Kvalitativ analyse beskriver for det meste data i SR-studier, mens kvantitativ analyse består af to hovedtyper: MA og netværksmetaanalyse (NMA). Undergruppe, følsomhed, kumulative analyser og metaregression er passende til at teste, om resultaterne er konsistente eller ej, og undersøge effekten af visse forvirrende på resultatet og finde de bedste forudsigere. Offentliggørelsesforstyrrelse bør vurderes for at undersøge tilstedeværelsen af manglende undersøgelser, der kan påvirke resuméet.
For at illustrere grundlæggende metaanalyse giver vi en imaginær data til forskningsspørgsmålet om Ebola-vaccines sikkerhed (med hensyn til uønsket hændelser, 14 dage efter injektion) og immunogenicitet (antistoffer til Ebola-virus stiger i geometrisk gennemsnitstiter 6 måneder efter injektion). Antager vi, at vi fra søgning og dataekstraktion besluttede at lave en analyse for at evaluere Ebola-vaccine “A” -sikkerhed og immunogenicitet. Andre ebolavacciner blev ikke metaanalyseret på grund af det begrænsede antal undersøgelser (i stedet vil det blive inkluderet til narrativ gennemgang De imaginære data til metaanalyse af vaccinesikkerhed kan tilgås i yderligere fil 7: Data S2. For at udføre metaanalysen kan vi bruge gratis software, såsom RevMan eller R-pakke meta. I dette eksempel vil vi bruge R-pakke-metaen. Vejledningen til metapakke kan fås via “Generel pakke til metaanalyse” -vejledning pdf. R-koderne og dens vejledning til udført metaanalyse findes i yderligere fil 5: Fil S3.
Til analysen antager vi, at undersøgelsen er heterogen; derfor vælger vi en tilfældig effektmodel. Vi foretog en analyse af sikkerheden ved ebolavaccine A. Fra datatabellen kan vi se nogle bivirkninger, der forekommer efter intramuskulær injektion af vaccine A til emnet for undersøgelsen. Antag, at vi inkluderer seks undersøgelser, der opfylder vores inklusionskriterier. Vi kan lave en metaanalyse for hver af de bivirkninger, der er ekstraheret fra undersøgelserne, for eksempel arthralgi, fra resultaterne af metaanalyse med tilfældig effekt ved hjælp af R-metapakken.
Fra resultaterne vist i Yderligere fil 3: Figur S3, vi kan se, at oddsforholdet (OR) for arthralgi er 1,06 (0,79; 1,42), p-værdi = 0,71, hvilket betyder, at der ikke er nogen sammenhæng mellem den intramuskulære injektion af ebolavaccine A og artralgi, da OR næsten er en, og desuden er P-værdien ubetydelig, da den er > 0,05.
I metaanalysen kan vi også visualisere resulterer i en skovplot. Det er vist i fig. 3 et eksempel på en skovplot fra den simulerede analyse.
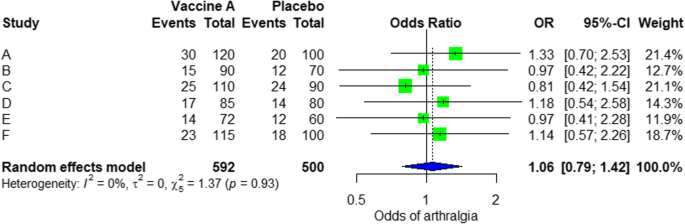
Random effekt model forest plot til sammenligning af vaccine A versus placebo
Fra skovplottet kan vi se seks undersøgelser (A til F) og deres respektive OR (95% CI) . Den grønne boks repræsenterer effektstørrelsen (i dette tilfælde OR) for hver undersøgelse. Jo større kassen betyder, at undersøgelsen vægtes mere (dvs. større stikprøvestørrelse). Den blå diamantform repræsenterer den samlede OR af de seks undersøgelser. Vi kan se den blå diamant krydse den lodrette linje OR = 1, hvilket ikke indikerer nogen betydning for foreningen, da diamanten næsten udlignede på begge sider. Vi kan også bekræfte dette fra 95% konfidensintervallet, der inkluderer en og p-værdien > 0,05.
For heterogenitet ser vi, at I2 = 0%, hvilket betyder, at der ikke detekteres heterogenitet; undersøgelsen er relativt homogen (det er sjældent i den virkelige undersøgelse). For at evaluere publikationsforstyrrelser relateret til metaanalysen af bivirkninger af artralgi kan vi bruge metabiasfunktionen fra R-metapakken (yderligere fil 4: figur S4) og visualisering ved hjælp af et tragtplot. Resultaterne af publikationsforstyrrelse er demonstreret i fig. 4. Vi ser, at p-værdien, der er knyttet til denne test, er 0,74, hvilket indikerer symmetri af tragtplottet. Vi kan bekræfte det ved at se på tragtplottet.
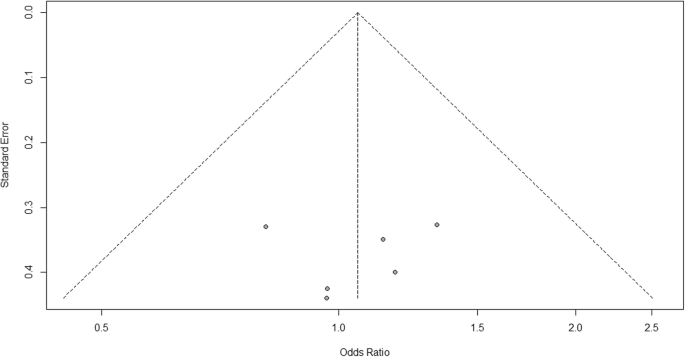
Bias-tragtdiagram til sammenligning af vaccine A versus placebo
Når man ser på tragtplottet, er antallet af undersøgelser i venstre og højre side af tragtplot det samme; derfor er plottet symmetri, hvilket indikerer, at der ikke er registreret nogen publikationsforstyrrelse.
Følsomhedsanalyse er en procedure, der bruges til at opdage, hvordan forskellige værdier af en uafhængig variabel vil påvirke betydningen af en bestemt afhængig variabel ved at fjerne en undersøgelse fra MA . Hvis alle inkluderede p-værdier er < 0,05, vil fjernelse af enhver undersøgelse derfor ikke ændre den signifikante sammenhæng. Det udføres kun, når der er en signifikant sammenhæng, så hvis p-værdien af MA udført er 0,7 – mere end én – er følsomhedsanalysen ikke nødvendig for dette eksempel på case study. Hvis der er 2 undersøgelser med p-værdi > 0,05, vil fjernelse af en af de to undersøgelser resultere i et tab af betydning.
Dobbelt datakontrol
For mere sikkerhed for kvaliteten af resultaterne skal de analyserede data kontrolleres igen fra fuldtekstdata ved hjælp af bevisfotos for at muliggøre en åbenbar kontrol af undersøgelsens PI.
Manuskriptskrivning, revision og indsendelse til en tidsskrift
Skrivning baseret på fire videnskabelige sektioner: introduktion, metoder, resultater og diskussion, mest med en konklusion. Udførelse af en karakteristisk tabel til undersøgelse og patientkarakteristika er et obligatorisk trin, som kan findes som en skabelon i yderligere fil 5: tabel S3.
Efter færdiggørelse af manuskriptskrivning, egenskabstabel og PRISMA-flowdiagram, holdet skal sende det til PI for at revidere det godt og svare på hans kommentarer og til sidst vælge en passende journal til manuskriptet, der passer med betydelig slagfaktor og passende felt. Vi er nødt til at være opmærksomme ved at læse forfatterens retningslinjer for tidsskrifter, inden vi indsender manuskriptet.
