L’amélioration du terme de recherche se fait en effectuant une recherche d’essai et en recherchant un autre terme pertinent au sein de chaque concept à partir des articles récupérés. Pour rechercher un essai clinique, nous pouvons utiliser ces descripteurs dans PubMed: « essai clinique » OU « essais cliniques comme sujet » OU « essai clinique ». Après quelques séries d’essais et affinement du terme de recherche, nous formulons le terme de recherche final pour PubMed comme suit: (virus ebola OU virus ebola OU maladie à virus ebola OU MVE) ET (vaccin OU vaccination OU vacciné OU immunisation) ET («essai clinique» OU «essais cliniques comme sujet» OU «essai clinique»). Étant donné que l’étude de ce sujet est limitée, nous n’incluons pas le terme de résultat (sécurité et immunogénicité) dans le terme de recherche pour capturer plus d’études.
Rechercher des bases de données, importer tous les résultats dans une bibliothèque et exporter vers un feuille Excel
Selon les directives AMSTAR, au moins deux bases de données doivent être recherchées dans le SR / MA, mais à mesure que vous augmentez le nombre de bases de données recherchées, vous obtenez beaucoup de rendement et des résultats plus précis et complets. L’ordre des bases de données dépend principalement des questions d’examen; étant dans une étude d’essais cliniques, vous vous fiez principalement à Cochrane, aux mRCT ou à la plateforme internationale d’enregistrement des essais cliniques (ICTRP). Ici, nous proposons 12 bases de données (PubMed, Scopus, Web of Science, EMBASE, GHL, VHL, Cochrane, Google Scholar, Clinical trial.gov, mRCTs, POPLINE et SIGLE), qui permettent de couvrir presque tous les articles publiés en médecine tropicale. et d’autres domaines liés à la santé. Parmi ces bases de données, POPLINE se concentre sur la santé reproductive. Les chercheurs devraient envisager de choisir une base de données pertinente en fonction du sujet de recherche. Certaines bases de données ne prennent pas en charge l’utilisation de booléen ou de devis; sinon, certaines bases de données ont un moyen de recherche spécial. Par conséquent, nous devons modifier les termes de recherche initiaux pour chaque base de données pour obtenir des résultats appréciés; par conséquent, des guides de manipulation pour chaque recherche de base de données en ligne sont présentés dans le fichier supplémentaire 5: tableau S2. La stratégie de recherche détaillée pour chaque base de données se trouve dans le fichier supplémentaire 5: tableau S3. Le terme de recherche que nous avons créé dans PubMed doit être personnalisé en fonction d’une caractéristique spécifique de la base de données. Voici un exemple de recherche avancée Google Scholar pour notre sujet:
-
Avec tous les mots: virus ebola
Avec au moins un des mots: vaccin vaccination vaccination vaccination
Où mes mots apparaissent: dans le titre de l’article
-
Avec tous les mots: MVE
Avec au moins un des mots: vaccin vaccination vaccination vaccinée
Où mes mots apparaissent: dans le titre de l’article
Enfin, tous les enregistrements sont collectés dans une bibliothèque Endnote afin de supprimer les doublons, puis de les exporter dans une feuille Excel. L’utilisation de la fonction de suppression de duplication avec deux options est obligatoire. Toutes les références ayant (1) le même titre et auteur, et publiées la même année, et (2) le même titre et auteur, et publiées dans la même revue, seraient supprimées. Les références restantes après cette étape doivent être exportées vers un fichier Excel contenant les informations essentielles pour le filtrage. Il peut s’agir des noms des auteurs, de l’année de publication, du journal, du DOI, du lien URL et du résumé.
Rédaction et enregistrement du protocole
L’enregistrement du protocole à un stade précoce garantit la transparence de la recherche processus et protège des problèmes de duplication. En outre, il est considéré comme une preuve documentée du plan d’action de l’équipe, de la question de recherche, des critères d’éligibilité, de l’intervention / exposition, de l’évaluation de la qualité et du plan de pré-analyse. Il est recommandé aux chercheurs de l’envoyer au chercheur principal (IP) pour le réviser, puis de le télécharger sur les sites du registre. Il existe de nombreux sites de registre disponibles pour la SR / MA comme ceux proposés par les collaborations Cochrane et Campbell; cependant, nous vous recommandons d’enregistrer le protocole dans PROSPERO car c’est plus simple. La mise en page d’un modèle de protocole, selon PROSPERO, peut être trouvée dans le fichier supplémentaire 5: Fichier S1.
Examen des titres et des résumés
Les décisions de sélectionner les articles récupérés pour une évaluation plus approfondie sont basées sur les critères d’éligibilité, afin de minimiser les chances d’inclure des articles non pertinents. Selon les directives Cochrane, deux examinateurs sont indispensables pour faire cette étape, mais comme pour les débutants et les jeunes chercheurs, cela pourrait être fastidieux; Ainsi, nous proposons, sur la base de notre expérience, qu’au moins trois examinateurs devraient travailler de manière indépendante pour réduire le risque d’erreur, en particulier dans des équipes avec un grand nombre d’auteurs, afin d’ajouter plus de contrôle et d’assurer une bonne conduite.La plupart du temps, la qualité avec trois examinateurs serait meilleure que deux, car deux seulement auraient des opinions différentes les unes des autres, de sorte qu’ils ne peuvent pas décider, alors que le troisième avis est crucial. Et voici quelques exemples de revues systématiques que nous avons menées en suivant la même stratégie (par un autre groupe de chercheurs de notre groupe de recherche) et publiées avec succès, et elles présentent des idées pertinentes sur la médecine tropicale et les maladies.
In cette étape, les doublons seront supprimés manuellement chaque fois que les réviseurs les découvriront. Lorsqu’il y a un doute sur la décision d’un article, l’équipe doit être inclusive plutôt qu’exclusive, jusqu’à ce que le chef principal ou l’IP prenne une décision après discussion et consensus. Tous les enregistrements exclus doivent avoir des raisons d’exclusion.
Téléchargement et filtrage du texte intégral
De nombreux moteurs de recherche proposent des liens gratuits pour accéder aux articles en texte intégral. Si vous ne le trouvez pas, nous pouvons rechercher dans certains sites Web de recherche comme ResearchGate, qui offre une option de demande directe de texte intégral des auteurs. En outre, explorer les archives des revues recherchées, ou contacter PI pour les acheter si disponible. De même, 2 à 3 examinateurs travaillent de manière indépendante pour décider des textes intégraux inclus en fonction des critères d’éligibilité, en indiquant les raisons d’exclusion d’articles. En cas de désaccord, la décision finale doit être prise par discussion.
Recherche manuelle
Il faut épuiser toutes les possibilités pour réduire le biais en effectuant une recherche manuelle explicite de récupération des rapports qui peuvent avoir été supprimés de la première recherche. Nous appliquons cinq méthodes pour effectuer une recherche manuelle: rechercher des références dans des études / revues incluses, contacter des auteurs et des experts, et consulter des articles connexes / articles cités dans PubMed et Google Scholar.
Nous décrivons ici trois méthodes consécutives pour augmenter et affiner le rendement de la recherche manuelle: premièrement, rechercher des listes de références d’articles inclus; deuxièmement, effectuer ce que l’on appelle le suivi des citations dans lequel les examinateurs suivent tous les articles qui citent chacun des articles inclus, ce qui pourrait impliquer une recherche électronique dans les bases de données; et troisièmement, comme pour le suivi des citations, nous suivons tous les articles «liés à» ou «similaires». Chacune des méthodes susmentionnées peut être effectuée par 2 à 3 évaluateurs indépendants, et tous les articles pertinents possibles doivent faire l’objet d’un examen plus approfondi par rapport aux critères d’inclusion, après avoir suivi les mêmes enregistrements issus des bases de données électroniques, à savoir, le titre / résumé et le filtrage du texte intégral .
Nous proposons une révision indépendante en attribuant à chaque membre des équipes un « tag » et une méthode distincte, pour compiler tous les résultats à la fin pour comparaison des différences et discussion et maximiser la récupération et minimiser De même, le nombre d’articles inclus doit être indiqué avant l’ajout à l’ensemble des enregistrements inclus.
Extraction des données et évaluation de la qualité
Cette étape autorise la collecte de données à partir des enregistrements complets inclus. textes dans une feuille Excel d’extraction structurée, qui a déjà fait l’objet d’un test pilote pour l’extraction à l’aide de certaines études aléatoires. Nous recommandons d’extraire des données ajustées et non ajustées car elle donne le facteur de confusion le plus autorisé à b e utilisé dans l’analyse en les regroupant plus tard. Le processus d’extraction doit être exécuté par 2 à 3 examinateurs indépendants. La plupart du temps, la feuille est classée dans l’étude et les caractéristiques du patient, les résultats et l’outil d’évaluation de la qualité (AQ).
Les données présentées dans les graphiques doivent être extraites par des outils logiciels tels que le numériseur de tracés Web. La plupart des équations qui peuvent être utilisées dans l’extraction avant l’analyse et l’estimation de l’écart type (ET) à partir d’autres variables se trouvent dans le fichier supplémentaire 5: fichier S2 avec leurs références comme Hozo et al. , Xiang et coll. et Rijkom et al. . Différents outils sont disponibles pour l’AQ, en fonction de la conception: Outil ROB-2 Cochrane pour les essais contrôlés randomisés qui est présenté comme Fichier supplémentaire 1: Figure S1 et Fichier supplémentaire 2: Figure S2 – à partir des données d’un article publié antérieurement -, Outil NIH pour les études observationnelles et transversales, outil ROBINS-I pour les essais non randomisés, outil QUADAS-2 pour les études diagnostiques, outil QUIPS pour les études pronostiques, outil CARE pour les rapports de cas et ToxRtool pour les études in vivo et in vitro. Nous recommandons que 2 à 3 évaluateurs évaluent indépendamment la qualité des études et les ajoutent au formulaire d’extraction des données avant leur inclusion dans l’analyse afin de réduire le risque de biais. Dans l’outil NIH pour les études observationnelles – cohorte et transversales – comme dans ce cas EBOLA, pour évaluer le risque de biais, les examinateurs doivent évaluer chacun des 14 items en variables dichotomiques: oui, non ou sans objet. Un score global est calculé en additionnant tous les scores des items comme oui vaut un, tandis que non et NA vaut zéro.Une note sera attribuée à chaque article afin de les classer comme études médiocres, passables ou bonnes, où une note de 0 à 5 était considérée comme médiocre, 6 à 9 comme passable et 10 à 14 comme bonne.
Dans l’exemple de cas EBOLA ci-dessus, les auteurs peuvent extraire les informations suivantes: nom des auteurs, pays des patients, année de publication, conception de l’étude (rapport de cas, étude de cohorte, ou essai clinique ou ECR), taille de l’échantillon, point infecté du temps après l’infection à EBOLA, intervalle de suivi après le moment de la vaccination, efficacité, sécurité, effets indésirables après les vaccinations et fiche d’assurance qualité (fichier supplémentaire 6: données S1).
Vérification des données
En raison de l’erreur humaine et du biais attendus, nous recommandons une étape de vérification des données, dans laquelle chaque article inclus est comparé à son homologue dans une feuille d’extraction par des photos de preuves, pour détecter les erreurs dans les données. Nous vous conseillons d’attribuer des articles à 2 à 3 évaluateurs indépendants, idéalement pas à ceux qui ont effectué l’extraction de ces articles. Lorsque les ressources sont limitées, chaque évaluateur se voit attribuer un article différent de celui qu’il a extrait à l’étape précédente.
Analyse statistique
Les enquêteurs utilisent différentes méthodes pour combiner et résumer les résultats des études incluses . Avant l’analyse, il y a une étape importante appelée nettoyage des données dans la feuille d’extraction, où l’analyste organise les données de la feuille d’extraction sous une forme qui peut être lue par un logiciel d’analyse. L’analyse se compose de 2 types à savoir l’analyse qualitative et quantitative. L’analyse qualitative décrit principalement les données dans les études SR, tandis que l’analyse quantitative se compose de deux types principaux: MA et méta-analyse en réseau (NMA). Le sous-groupe, la sensibilité, les analyses cumulatives et la méta-régression sont appropriés pour tester si les résultats sont cohérents ou non et étudier l’effet de certains facteurs de confusion sur le résultat et trouver les meilleurs prédicteurs. Le biais de publication doit être évalué pour rechercher la présence d’études manquantes susceptibles d’affecter le résumé.
Pour illustrer la méta-analyse de base, nous fournissons des données imaginaires pour la question de recherche sur la sécurité du vaccin Ebola (en termes de événements, 14 jours après l’injection) et l’immunogénicité (les anticorps anti-virus Ebola augmentent en moyenne géométrique, 6 mois après l’injection). En supposant qu’à partir de la recherche et de l’extraction des données, nous avons décidé de faire une analyse pour évaluer l’innocuité et l’immunogénicité du vaccin Ebola «A». D’autres vaccins contre le virus Ebola n’ont pas été méta-analysés en raison du nombre limité d’études (ils seront plutôt inclus pour un examen narratif ). Les données imaginaires pour la méta-analyse de la sécurité des vaccins sont accessibles dans le fichier supplémentaire 7: Données S2. Pour effectuer la méta-analyse, nous pouvons utiliser un logiciel gratuit, tel que RevMan ou R package meta. Dans cet exemple, nous utiliserons le méta du package R. Le tutoriel du méta-package est accessible via le pdf du tutoriel « Package général pour la méta-analyse ». Les codes R et ses conseils pour la méta-analyse peuvent être trouvés dans le fichier supplémentaire 5: Fichier S3.
Pour l’analyse, nous supposons que l’étude est de nature hétérogène; par conséquent, nous choisissons un modèle à effets aléatoires. Nous avons fait une analyse sur la sécurité du vaccin Ebola A. A partir du tableau de données, nous pouvons voir certains événements indésirables survenant après l’injection intramusculaire du vaccin A au sujet de l’étude. Supposons que nous incluions six études qui remplissent nos critères d’inclusion. Nous pouvons faire une méta-analyse pour chacun des événements indésirables extraits des études, par exemple, l’arthralgie, à partir des résultats de la méta-analyse des effets aléatoires à l’aide du méta-package R.
À partir des résultats présentés dans Fiche supplémentaire 3: Figure S3, on peut voir que l’odds ratio (OR) de l’arthralgie est de 1,06 (0,79; 1,42), valeur p = 0,71, ce qui signifie qu’il n’y a pas d’association entre l’injection intramusculaire du vaccin Ebola A et l’arthralgie, car le OU est presque un, et en plus, la valeur P est insignifiante car elle est > 0,05.
Dans la méta-analyse, nous pouvons également visualiser le donne une parcelle forestière. La figure 3 montre un exemple de parcelle forestière à partir de l’analyse simulée.
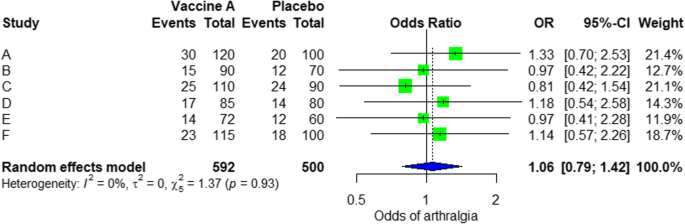
Diagramme de forêt modèle à effet aléatoire pour la comparaison du vaccin A par rapport au placebo
À partir de la parcelle forestière, nous pouvons voir six études (A à F) et leur OR respectif (IC à 95%) . La case verte représente la taille de l’effet (dans ce cas, OR) de chaque étude. Plus la case est grande, plus l’étude est pondérée (c’est-à-dire une taille d’échantillon plus grande). La forme de losange bleu représente le OU groupé des six études. On peut voir le losange bleu traverser la ligne verticale OR = 1, ce qui n’indique aucune signification pour l’association car le losange est presque égalisé des deux côtés. Nous pouvons également le confirmer à partir de l’intervalle de confiance à 95% qui comprend un et la valeur p > 0,05.
Pour l’hétérogénéité, nous voyons que I2 = 0%, ce qui signifie qu’aucune hétérogénéité n’est détectée; l’étude est relativement homogène (c’est rare dans l’étude réelle). Pour évaluer le biais de publication lié à la méta-analyse des événements indésirables de l’arthralgie, nous pouvons utiliser la fonction metabias du méta package R (fichier supplémentaire 4: figure S4) et la visualisation à l’aide d’un graphique en entonnoir. Les résultats du biais de publication sont démontrés sur la figure 4. Nous voyons que la valeur p associée à ce test est de 0,74, indiquant la symétrie du tracé en entonnoir. Nous pouvons le confirmer en regardant le tracé en entonnoir.
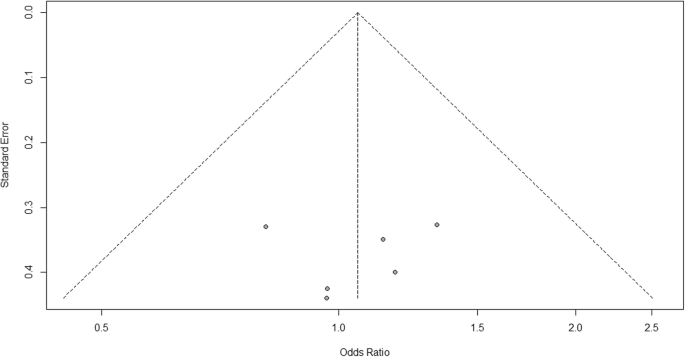
Graphique en entonnoir de biais de publication pour la comparaison du vaccin A par rapport au placebo
En regardant le graphique en entonnoir, le nombre d’études à gauche et à droite du graphique en entonnoir est le même; par conséquent, le graphique est une symétrie, indiquant qu’aucun biais de publication n’a été détecté.
L’analyse de sensibilité est une procédure utilisée pour découvrir comment différentes valeurs d’une variable indépendante vont influencer la signification d’une variable dépendante particulière en supprimant une étude de MA . Si toutes les valeurs de p des études incluses sont < 0,05, par conséquent, la suppression d’une étude ne changera pas l’association significative. Elle n’est effectuée que lorsqu’il existe une association significative, donc si la valeur p de MA effectuée est de 0,7 – plus d’un – l’analyse de sensibilité n’est pas nécessaire pour cet exemple d’étude de cas. S’il y a 2 études avec une valeur p > 0,05, la suppression de l’une des deux études entraînera une perte de signification.
Double vérification des données
Pour plus de certitude sur la qualité des résultats, les données analysées doivent être revérifiées à partir des données en texte intégral par des photos de preuves, afin de permettre une vérification évidente de l’IP de l’étude.
Rédaction de manuscrits, révision et soumission à une revue
Rédaction basée sur quatre sections scientifiques: introduction, méthodes, résultats et discussion, le plus souvent avec une conclusion. La réalisation d’un tableau de caractéristiques pour l’étude et les caractéristiques du patient est une étape obligatoire qui peut être trouvée comme modèle dans le fichier supplémentaire 5: Tableau S3.
Après avoir terminé l’écriture du manuscrit, le tableau des caractéristiques et le diagramme PRISMA, le L’équipe devrait l’envoyer au chercheur principal pour bien le réviser et répondre à ses commentaires et, enfin, choisir un journal approprié pour le manuscrit qui correspond à un facteur d’impact considérable et à un domaine d’application. Nous devons faire attention en lisant les directives de l’auteur des revues avant de soumettre le manuscrit.
