Die Verbesserung des Suchbegriffs erfolgt während einer Testsuche und der Suche nach einem anderen relevanten Begriff innerhalb jedes Konzepts aus abgerufenen Papieren. Um nach einer klinischen Studie zu suchen, können wir diese Deskriptoren in PubMed verwenden: „klinische Studie“ ODER „klinische Studien als Thema“ ODER „klinische Studie“. Nach einigen Runden der Studie und der Verfeinerung des Suchbegriffs formulieren wir den endgültigen Suchbegriff für PubMed wie folgt: (Ebola ODER Ebola-Virus ODER Ebola-Virus-Krankheit ODER EVD) UND (Impfstoff ODER Impfung ODER geimpfte ODER Immunisierung) UND („klinische Studie“ ODER „klinische Studien als Thema“ ODER „klinische Studie“). Da die Studie zu diesem Thema begrenzt ist, nehmen wir keinen Ergebnisbegriff (Sicherheit und Immunogenität) in den Suchbegriff auf, um weitere Studien zu erfassen.
Durchsuchen Sie Datenbanken, importieren Sie alle Ergebnisse in eine Bibliothek und exportieren Sie sie in eine Excel-Tabelle
Gemäß den AMSTAR-Richtlinien müssen mindestens zwei Datenbanken in der SR / MA durchsucht werden. Wenn Sie jedoch die Anzahl der durchsuchten Datenbanken erhöhen, erhalten Sie viel Ertrag und genauere und umfassendere Ergebnisse. Die Reihenfolge der Datenbanken hängt hauptsächlich von den Überprüfungsfragen ab. Wenn Sie an einer Studie über klinische Studien teilnehmen, verlassen Sie sich hauptsächlich auf Cochrane, mRCTs oder die International Clinical Trials Registry Platform (ICTRP). Hier schlagen wir 12 Datenbanken vor (PubMed, Scopus, Web of Science, EMBASE, GHL, VHL, Cochrane, Google Scholar, Clinical Trials.gov, mRCTs, POPLINE und SIGLE), die dazu beitragen, fast alle veröffentlichten Artikel in der Tropenmedizin abzudecken und andere gesundheitsbezogene Bereiche. Unter diesen Datenbanken konzentriert sich POPLINE auf die reproduktive Gesundheit. Forscher sollten in Betracht ziehen, die relevante Datenbank entsprechend dem Forschungsthema auszuwählen. Einige Datenbanken unterstützen die Verwendung von Booleschen Werten oder Zitaten nicht. Andernfalls gibt es einige Datenbanken mit speziellen Suchmethoden. Daher müssen wir die anfänglichen Suchbegriffe für jede Datenbank ändern, um geschätzte Ergebnisse zu erhalten. Daher finden Sie in der Zusatzdatei 5: Tabelle S2 Manipulationshandbücher für jede Online-Datenbanksuche. Die detaillierte Suchstrategie für jede Datenbank finden Sie in der Zusatzdatei 5: Tabelle S3. Der Suchbegriff, den wir in PubMed erstellt haben, muss basierend auf einem bestimmten Merkmal der Datenbank angepasst werden. Ein Beispiel für die erweiterte Suche von Google Scholar nach unserem Thema lautet wie folgt:
-
Mit allen Wörtern: Ebola-Virus
Mit mindestens einem der Wörter: Impfung Impfung geimpfte Impfung
Wo meine Worte vorkommen: im Titel des Artikels
-
Mit allen Worten: EVD
Mit mindestens einem der Wörter: Impfstoffimpfung geimpfte Immunisierung
Wo meine Wörter vorkommen: im Titel des Artikels
Schließlich sind alle Aufzeichnungen in einer Endnote-Bibliothek gesammelt, um Duplikate zu löschen und dann in eine Excel-Tabelle zu exportieren. Die Verwendung der Funktion zum Entfernen von Duplikaten mit zwei Optionen ist obligatorisch. Alle Referenzen, die (1) denselben Titel und Autor haben und im selben Jahr veröffentlicht wurden und (2) denselben Titel und denselben Autor haben und in derselben Zeitschrift veröffentlicht wurden, werden gelöscht. Nach diesem Schritt verbleibende Referenzen sollten in eine Excel-Datei mit wichtigen Informationen für das Screening exportiert werden. Dies können die Namen der Autoren, das Erscheinungsjahr, das Journal, der DOI, der URL-Link und das Abstract sein.
Protokollschreiben und Registrierung
Die frühzeitige Registrierung des Protokolls garantiert Transparenz in der Forschung verarbeiten und schützt vor Duplizierungsproblemen. Außerdem wird es als dokumentierter Nachweis des Teamaktionsplans, der Forschungsfrage, der Zulassungskriterien, der Intervention / Exposition, der Qualitätsbewertung und des Voranalyseplans angesehen. Es wird empfohlen, dass Forscher es an den Principal Investigator (PI) senden, um es zu überarbeiten, und es dann auf Registrierungsseiten hochladen. Es gibt viele Registrierungsseiten für SR / MA, wie sie von Cochrane- und Campbell-Kooperationen vorgeschlagen wurden. Wir empfehlen jedoch, das Protokoll bei PROSPERO zu registrieren, da dies einfacher ist. Das Layout einer Protokollvorlage befindet sich laut PROSPERO in der Zusatzdatei 5: Datei S1.
Titel- und Abstract-Screening
Entscheidungen zur Auswahl der abgerufenen Artikel zur weiteren Bewertung basieren nach Zulassungskriterien, um die Wahrscheinlichkeit zu minimieren, nicht relevante Artikel aufzunehmen. Nach den Leitlinien von Cochrane sind zwei Gutachter ein Muss, um diesen Schritt durchzuführen. Für Anfänger und Nachwuchsforscher kann dies jedoch lästig sein. Aus unserer Erfahrung schlagen wir daher vor, dass mindestens drei Prüfer unabhängig voneinander arbeiten sollten, um die Fehlerwahrscheinlichkeit zu verringern, insbesondere in Teams mit einer großen Anzahl von Autoren, um eine genauere Prüfung durchzuführen und ein ordnungsgemäßes Verhalten sicherzustellen.Meistens wäre die Qualität mit drei Gutachtern besser als zwei, da nur zwei unterschiedliche Meinungen voneinander haben, so dass sie sich nicht entscheiden können, während die dritte Meinung entscheidend ist. Und hier sind einige Beispiele für systematische Überprüfungen, die wir nach derselben Strategie (von einer anderen Gruppe von Forschern in unserer Forschungsgruppe) durchgeführt und erfolgreich veröffentlicht haben und die relevante Ideen für die Tropenmedizin und -krankheiten enthalten.
In In diesem Schritt werden Duplikate manuell entfernt, sobald die Prüfer sie herausfinden. Wenn Zweifel an einer Artikelentscheidung bestehen, sollte das Team eher inklusiv als exklusiv sein, bis der Hauptleiter oder PI nach Diskussion und Konsens eine Entscheidung trifft. Alle ausgeschlossenen Datensätze sollten mit Ausschlussgründen versehen werden.
Herunterladen und Überprüfen von Volltext
Viele Suchmaschinen bieten kostenlose Links für den Zugriff auf Volltextartikel. Falls nicht gefunden, können wir auf einigen Forschungswebsites als ResearchGate suchen, die die Möglichkeit einer direkten Volltextanfrage von Autoren bieten. Durchsuchen Sie außerdem Archive gewünschter Zeitschriften oder wenden Sie sich an PI, um diese zu erwerben, falls verfügbar. In ähnlicher Weise arbeiten 2 bis 3 Prüfer unabhängig voneinander, um über eingeschlossene Volltexte nach Zulassungskriterien zu entscheiden, wobei Ausschlussgründe für Artikel gemeldet werden. Falls es zu Meinungsverschiedenheiten gekommen ist, muss die endgültige Entscheidung durch Diskussion getroffen werden.
Manuelle Suche
Man muss alle Möglichkeiten ausschöpfen, um die Verzerrung durch eine explizite Handsuche zu verringern Abrufen von Berichten, die möglicherweise von der ersten Suche gelöscht wurden. Wir wenden fünf Methoden an, um manuell zu suchen: Suchen von Referenzen aus eingeschlossenen Studien / Rezensionen, Kontaktaufnahme mit Autoren und Experten und Betrachten verwandter Artikel / zitierter Artikel in PubMed und Google Scholar.
Wir beschreiben hier drei aufeinanderfolgende Methoden Erhöhen und verfeinern Sie den Ertrag der manuellen Suche: Erstens die Suche nach Referenzlisten der enthaltenen Artikel; Zweitens: Durchführen einer so genannten Zitierverfolgung, bei der die Prüfer alle Artikel verfolgen, in denen die einzelnen enthaltenen Artikel zitiert werden. Dies kann eine elektronische Suche in Datenbanken umfassen. und drittens folgen wir, ähnlich wie bei der Zitierverfolgung, allen „verwandten“ oder „ähnlichen“ Artikeln. Jede der oben genannten Methoden kann von 2 bis 3 unabhängigen Gutachtern durchgeführt werden, und alle möglichen relevanten Artikel müssen anhand der Einschlusskriterien einer weiteren Prüfung unterzogen werden, nachdem dieselben Aufzeichnungen aus elektronischen Datenbanken, dh Titel- / Abstract- und Volltext-Screening, befolgt wurden
Wir schlagen eine unabhängige Überprüfung vor, indem wir jedem Teammitglied ein „Tag“ und eine eigene Methode zuweisen, um alle Ergebnisse am Ende zum Vergleich von Unterschieden und Diskussionen zusammenzustellen und den Abruf zu maximieren und zu minimieren In ähnlicher Weise muss die Anzahl der enthaltenen Artikel angegeben werden, bevor sie zu den insgesamt enthaltenen Datensätzen hinzugefügt werden.
Datenextraktion und Qualitätsbewertung
Dieser Schritt berechtigt zur Datenerfassung aus den enthaltenen vollständigen Artikeln. Texte in einem strukturierten Extraktions-Excel-Blatt, das zuvor anhand einiger Zufallsstudien für die Extraktion pilotgetestet wurde. Wir empfehlen, sowohl angepasste als auch nicht angepasste Daten zu extrahieren, da dies b den zulässigsten Störfaktor ergibt Sie werden in der Analyse verwendet, indem sie später zusammengefasst werden. Der Extraktionsprozess sollte von 2–3 unabhängigen Gutachtern durchgeführt werden. In den meisten Fällen wird das Blatt in das Tool für Studien- und Patientenmerkmale, Ergebnisse und Qualitätsbewertung (QS) eingeteilt.
In Diagrammen dargestellte Daten sollten mit Softwaretools wie dem Webplot-Digitalisierer extrahiert werden. Die meisten Gleichungen, die bei der Extraktion vor der Analyse und Schätzung der Standardabweichung (SD) von anderen Variablen verwendet werden können, befinden sich in der Zusatzdatei 5: Datei S2 mit ihren Referenzen als Hozo et al. Xiang et al. und Rijkom et al. . Für die Qualitätssicherung stehen je nach Design verschiedene Tools zur Verfügung: ROB-2 Cochrane-Tool für randomisierte kontrollierte Studien, das als Zusatzdatei 1: Abbildung S1 und Zusatzdatei 2: Abbildung S2 – aus zuvor veröffentlichten Artikeldaten – dargestellt wird; NIH-Tool für Beobachtungs- und Querschnittsstudien, ROBINS-I-Tool für nicht randomisierte Studien, QUADAS-2-Tool für diagnostische Studien, QUIPS-Tool für Prognosestudien, CARE-Tool für Fallberichte und ToxRtool für In-vivo- und In-vitro-Studien. Wir empfehlen 2–3 Gutachtern, die Qualität der Studien unabhängig zu bewerten und das Datenextraktionsformular vor der Aufnahme in die Analyse zu ergänzen, um das Verzerrungspotenzial zu verringern. Im NIH-Tool für Beobachtungsstudien – Kohorte und Querschnitt – wie in diesem EBOLA-Fall sollten Prüfer zur Bewertung des Verzerrungspotenzials jeden der 14 Punkte in dichotome Variablen einteilen: Ja, Nein oder Nicht zutreffend. Eine Gesamtpunktzahl wird berechnet, indem alle Punktzahlen addiert werden, da Ja gleich Eins ist, während Nein und NA gleich Null sind.Für jede Arbeit wird eine Bewertung vergeben, um sie als schlecht, fair oder gut durchgeführte Studien einzustufen, wobei eine Bewertung von 0 bis 5 als schlecht, 6 bis 9 als fair und 10 bis 14 als gut eingestuft wurde.
Im obigen EBOLA-Fallbeispiel können Autoren die folgenden Informationen extrahieren: Name der Autoren, Land der Patienten, Erscheinungsjahr, Studiendesign (Fallbericht, Kohortenstudie oder klinische Studie oder RCT), Stichprobengröße, Infektionspunkt Zeit nach EBOLA-Infektion, Follow-up-Intervall nach Impfzeit, Wirksamkeit, Sicherheit, Nebenwirkungen nach Impfungen und QS-Blatt (Zusatzdatei 6: Daten S1).
Datenprüfung
Aufgrund des erwarteten menschlichen Fehlers und der erwarteten Voreingenommenheit empfehlen wir einen Datenprüfungsschritt, bei dem jeder enthaltene Artikel mit seinem Gegenstück in einem Extraktionsblatt anhand von Beweisfotos verglichen wird, um Fehler in Daten zu erkennen. Wir empfehlen, Artikel 2 bis 3 unabhängigen Gutachtern zuzuweisen, im Idealfall nicht denjenigen, die die Extraktion dieser Artikel durchgeführt haben. Wenn die Ressourcen begrenzt sind, wird jedem Prüfer ein anderer Artikel zugewiesen als der, den er in der vorherigen Phase extrahiert hat.
Statistische Analyse
Die Ermittler verwenden unterschiedliche Methoden, um die Ergebnisse der eingeschlossenen Studien zu kombinieren und zusammenzufassen . Vor der Analyse gibt es einen wichtigen Schritt, das Bereinigen von Daten im Extraktionsblatt, bei dem der Analytiker die Daten des Extraktionsblatts in einer Form organisiert, die von der Analysesoftware gelesen werden kann. Die Analyse besteht aus 2 Arten, nämlich der qualitativen und der quantitativen Analyse. Die qualitative Analyse beschreibt hauptsächlich Daten in SR-Studien, während die quantitative Analyse aus zwei Haupttypen besteht: MA und Netzwerk-Metaanalyse (NMA). Untergruppe, Sensitivität, kumulative Analysen und Meta-Regression sind geeignet, um zu testen, ob die Ergebnisse konsistent sind oder nicht, und um die Auswirkung bestimmter Störfaktoren auf das Ergebnis zu untersuchen und die besten Prädiktoren zu finden. Die Publikationsverzerrung sollte bewertet werden, um das Vorhandensein fehlender Studien zu untersuchen, die sich auf die Zusammenfassung auswirken können.
Zur Veranschaulichung der grundlegenden Metaanalyse liefern wir imaginäre Daten für die Forschungsfrage zur Sicherheit von Ebola-Impfstoffen (in Bezug auf Nebenwirkungen) Ereignisse, 14 Tage nach der Injektion) und Immunogenität (Ebola-Virus-Antikörper steigen 6 Monate nach der Injektion im geometrischen mittleren Titer an). Unter der Annahme, dass wir aufgrund der Suche und Datenextraktion eine Analyse durchgeführt haben, um die Sicherheit und Immunogenität des Ebola-Impfstoffs „A“ zu bewerten. Andere Ebola-Impfstoffe wurden aufgrund der begrenzten Anzahl von Studien nicht metaanalysiert (stattdessen werden sie zur narrativen Überprüfung einbezogen Auf die imaginären Daten für die Impfstoffsicherheits-Metaanalyse kann in der Zusatzdatei 7: Daten S2 zugegriffen werden. Für die Metaanalyse können wir freie Software wie RevMan oder R-Paket-Meta verwenden. In diesem Beispiel verwenden wir Das Tutorial des Meta-Pakets kann über das Tutorial „Allgemeines Paket für die Metaanalyse“ im PDF-Format aufgerufen werden. Die R-Codes und ihre Anleitung für die durchgeführte Metaanalyse finden Sie in der zusätzlichen Datei 5: Datei S3.
Für die Analyse gehen wir davon aus, dass die Studie heterogener Natur ist. Daher wählen wir ein Zufallseffektmodell. Wir haben eine Analyse zur Sicherheit von Ebola-Impfstoff A durchgeführt. Aus der Datentabelle können wir einige unerwünschte Ereignisse sehen, die nach intramuskulärer Injektion von Impfstoff A in das Untersuchungsobjekt auftreten. Angenommen, wir schließen sechs Studien ein, die unsere Einschlusskriterien erfüllen. Wir können eine Metaanalyse für jedes der unerwünschten Ereignisse durchführen, die aus den Studien, z. B. Arthralgie, aus den Ergebnissen der Metaanalyse mit zufälligen Effekten unter Verwendung des R-Metapakets extrahiert wurden.
Aus den in gezeigten Ergebnissen Zusätzliche Datei 3: In Abbildung S3 sehen wir, dass das Odds Ratio (OR) der Arthralgie 1,06 (0,79; 1,42) beträgt, p-Wert = 0,71, was bedeutet, dass kein Zusammenhang zwischen der intramuskulären Injektion von Ebola-Impfstoff A und Arthralgie besteht. Da der OR fast eins ist und außerdem der P-Wert unbedeutend ist, da er > 0,05 ist.
In der Metaanalyse können wir auch den visualisieren führt zu einem Waldgrundstück. In 3 ist ein Beispiel eines Waldplots aus der simulierten Analyse gezeigt.
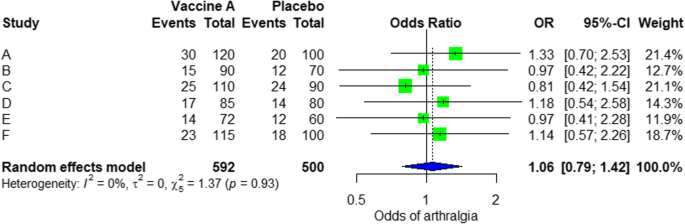
Modell-Walddiagramm mit Zufallseffekt zum Vergleich von Impfstoff A mit Placebo
Auf dem Waldgrundstück sehen wir sechs Studien (A bis F) und ihren jeweiligen OR (95% CI). . Das grüne Kästchen repräsentiert die Effektgröße (in diesem Fall OR) jeder Studie. Je größer die Box ist, desto stärker wird die Studie gewichtet (d. H. Je größer die Stichprobe). Die blaue Diamantform repräsentiert den gepoolten OP der sechs Studien. Wir können sehen, dass der blaue Diamant die vertikale Linie OR = 1 kreuzt, was keine Bedeutung für die Assoziation anzeigt, da der Diamant auf beiden Seiten fast ausgeglichen ist. Wir können dies auch anhand des 95% -Konfidenzintervalls bestätigen, das eins und den p-Wert > 0,05 enthält.
Für die Heterogenität sehen wir, dass I2 = 0% ist, was bedeutet, dass keine Heterogenität festgestellt wird; Die Studie ist relativ homogen (in der realen Studie selten). Um die Publikationsverzerrung im Zusammenhang mit der Metaanalyse unerwünschter Ereignisse von Arthralgie zu bewerten, können wir die Metabias-Funktion aus dem R-Metapaket (Zusatzdatei 4: Abbildung S4) und die Visualisierung mithilfe eines Trichterdiagramms verwenden. Die Ergebnisse der Publikationsverzerrung sind in 4 gezeigt. Wir sehen, dass der mit diesem Test verbundene p-Wert 0,74 beträgt, was auf eine Symmetrie des Trichterdiagramms hinweist. Wir können dies bestätigen, indem wir uns das Trichterdiagramm ansehen.
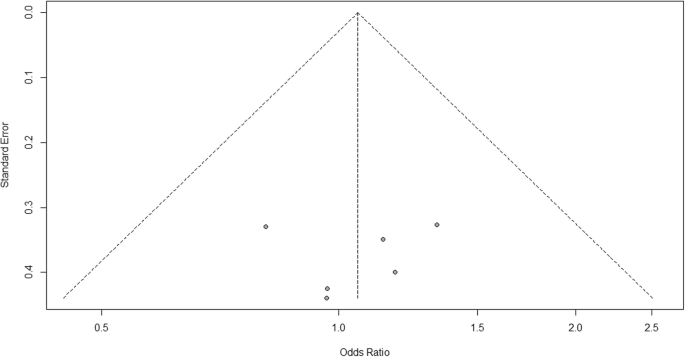
Diagramm des Publikationsbias-Trichters zum Vergleich von Impfstoff A mit Placebo
Beim Betrachten des Trichterplots ist die Anzahl der Studien auf der linken und rechten Seite des Trichterplots gleich. Daher ist das Diagramm symmetrisch, was darauf hinweist, dass keine Publikationsverzerrung festgestellt wurde.
Die Sensitivitätsanalyse ist ein Verfahren, mit dem ermittelt wird, wie unterschiedliche Werte einer unabhängigen Variablen die Signifikanz einer bestimmten abhängigen Variablen beeinflussen, indem eine Studie aus MA entfernt wird . Wenn alle eingeschlossenen p-Werte der Studie < 0,05 sind, ändert das Entfernen einer Studie die signifikante Assoziation nicht. Es wird nur durchgeführt, wenn eine signifikante Assoziation besteht. Wenn also der p-Wert von MA 0,7 beträgt – mehr als eins -, ist die Sensitivitätsanalyse für dieses Fallstudienbeispiel nicht erforderlich. Wenn es 2 Studien mit einem p-Wert > 0,05 gibt, führt das Entfernen einer der beiden Studien zu einem Verlust der Signifikanz.
Doppelte Datenprüfung
Um die Qualität der Ergebnisse besser zu gewährleisten, sollten die analysierten Daten anhand von Beweisfotos aus den Volltextdaten überprüft werden, um eine offensichtliche Überprüfung des PI der Studie zu ermöglichen.
Manuskriptschreiben, Überarbeitung und Einreichung in einer Zeitschrift
Schreiben basierend auf vier wissenschaftlichen Abschnitten: Einführung, Methoden, Ergebnisse und Diskussion, meist mit einer Schlussfolgerung. Das Durchführen einer Merkmalstabelle für Studien- und Patientenmerkmale ist ein obligatorischer Schritt, der als Vorlage in der Zusatzdatei 5: Tabelle S3 zu finden ist.
Nach Abschluss des Manuskriptschreibens, der Merkmalstabelle und des PRISMA-Flussdiagramms wird die Das Team sollte es an den PI senden, um es gut zu überarbeiten und auf seine Kommentare zu antworten, und schließlich ein geeignetes Journal für das Manuskript auswählen, das zu einem erheblichen Einflussfaktor und Anpassungsfeld passt. Wir müssen die Autorenrichtlinien von Zeitschriften lesen, bevor wir das Manuskript einreichen.
