Poprawa wyszukiwanego hasła następuje podczas wyszukiwania próbnego i szukania innego odpowiedniego terminu w ramach każdej koncepcji z pobranych dokumentów. Aby wyszukać badanie kliniczne, możemy użyć tych deskryptorów w PubMed: „badanie kliniczne” LUB „badania kliniczne jako temat” LUB „badanie kliniczne”. Po kilku rundach badań i udoskonaleniu wyszukiwanego hasła formułujemy ostateczny termin wyszukiwania dla PubMed w następujący sposób: (ebola LUB wirus ebola LUB choroba wirusowa ebola LUB EVD) ORAZ (szczepionka LUB szczepienie LUB szczepienie LUB immunizacja) ORAZ („badanie kliniczne” LUB „badania kliniczne jako temat” LUB „badanie kliniczne”). Ponieważ badanie na ten temat jest ograniczone, nie uwzględniamy terminu wyniku (bezpieczeństwo i immunogenność) w wyszukiwanym terminie, aby uchwycić więcej badań.
Przeszukuj bazy danych, importuj wszystkie wyniki do biblioteki i eksportuj do arkusz programu Excel
Zgodnie z wytycznymi AMSTAR, w SR / MA należy przeszukać co najmniej dwie bazy danych, ale w miarę zwiększania liczby przeszukiwanych baz danych uzyskuje się dużo większą wydajność oraz dokładniejsze i bardziej wyczerpujące wyniki. Kolejność baz danych zależy głównie od pytań przeglądowych; będąc w trakcie badań klinicznych, będziesz polegać głównie na Cochrane, mRCT lub International Clinical Trials Registry Platform (ICTRP). Tutaj proponujemy 12 baz danych (PubMed, Scopus, Web of Science, EMBASE, GHL, VHL, Cochrane, Google Scholar, Clinical trials.gov, mRCTs, POPLINE i SIGLE), które pomagają pokryć prawie wszystkie opublikowane artykuły z medycyny tropikalnej i inne dziedziny związane ze zdrowiem. Wśród tych baz danych POPLINE koncentruje się na zdrowiu reprodukcyjnym. Badacze powinni rozważyć wybór odpowiedniej bazy danych zgodnie z tematem badań. Niektóre bazy danych nie obsługują użycia wartości logicznych ani cudzysłowów; w przeciwnym razie istnieją bazy danych, które mają specjalny sposób wyszukiwania. Dlatego musimy zmodyfikować początkowe terminy wyszukiwania dla każdej bazy danych, aby uzyskać wartościowe wyniki; w związku z tym wskazówki dotyczące manipulacji dla każdego wyszukiwania w bazie danych online są przedstawione w Dodatkowym pliku 5: Tabela S2. Szczegółową strategię wyszukiwania dla każdej bazy danych można znaleźć w Dodatkowym pliku 5: Tabela S3. Wyszukiwane hasło, które stworzyliśmy w PubMed, wymaga dostosowania w oparciu o określoną charakterystykę bazy danych. Przykład zaawansowanego wyszukiwania naszego tematu w Google Scholar jest następujący:
-
Ze wszystkimi słowami: wirus ebola
Z co najmniej jednym ze słów: szczepienie szczepienie szczepienie szczepienie
Gdzie moje słowa występują: w tytule artykułu
-
Ze wszystkimi słowami: EVD
Z co najmniej jednym ze słów: szczepionka szczepienie szczepienie
Gdzie moje słowa występują: w tytule artykułu
Na koniec wszystkie zapisy są zebrane w jednej bibliotece Endnote, aby usunąć duplikaty, a następnie wyeksportować je do arkusza Excela. Korzystanie z funkcji usuwania duplikatów z dwiema opcjami jest obowiązkowe. Wszystkie pozycje bibliograficzne, które (1) mają ten sam tytuł i autora, zostały opublikowane w tym samym roku, oraz (2) mają ten sam tytuł i autora, i zostały opublikowane w tym samym czasopiśmie, zostałyby usunięte. Odnośniki pozostałe po tym kroku należy wyeksportować do pliku Excela z niezbędnymi informacjami do selekcji. Mogą to być nazwiska autorów, rok publikacji, czasopisma, DOI, link URL i streszczenie.
Pisanie i rejestracja protokołu
Rejestracja protokołu na wczesnym etapie gwarantuje przejrzystość badań przetwarzają i chroni przed problemami z powielaniem. Poza tym jest uważany za udokumentowany dowód planu działania zespołu, pytania badawczego, kryteriów kwalifikowalności, interwencji / narażenia, oceny jakości i planu wstępnej analizy. Zaleca się, aby badacze przesłali go do głównego badacza (PI) w celu poprawienia, a następnie przesłali do witryn rejestru. Istnieje wiele witryn rejestru dostępnych dla SR / MA, takich jak te proponowane przez współpracę Cochrane i Campbell; jednak zalecamy zarejestrowanie protokołu w PROSPERO, ponieważ jest to łatwiejsze. Układ szablonu protokołu, zgodnie z PROSPERO, można znaleźć w Dodatkowym pliku 5: Plik S1.
Przegląd tytułu i streszczenia
Decyzje o wyborze pobranych artykułów do dalszej oceny są podejmowane na podstawie decyzji w sprawie kryteriów kwalifikowalności, aby zminimalizować możliwość uwzględnienia nieistotnych artykułów. Zgodnie z wytycznymi Cochrane, dwóch recenzentów jest koniecznych do wykonania tego kroku, ale zarówno dla początkujących, jak i młodszych badaczy może to być męczące; w związku z tym, w oparciu o nasze doświadczenie, proponujemy, aby co najmniej trzech recenzentów pracowało niezależnie, aby zmniejszyć ryzyko błędu, szczególnie w zespołach z dużą liczbą autorów, aby dokładniej przeanalizować i zapewnić właściwe postępowanie.Przeważnie jakość przy trzech recenzentach byłaby lepsza niż dwóch, ponieważ tylko dwóch miałoby różne opinie od siebie, więc nie mogą się zdecydować, podczas gdy trzecia opinia jest kluczowa. A oto kilka przykładów systematycznych przeglądów, które przeprowadziliśmy zgodnie z tą samą strategią (przez inną grupę badaczy z naszej grupy badawczej) i które z powodzeniem opublikowaliśmy, i zawierają one istotne pomysły dotyczące medycyny tropikalnej i chorób.
W na tym etapie duplikaty zostaną usunięte ręcznie, gdy tylko recenzenci je znajdą. W przypadku wątpliwości co do decyzji dotyczącej artykułu, zespół powinien być otwarty, a nie wyłączny, dopóki główny lider lub kierownik nie podejmie decyzji po dyskusji i konsensusie. We wszystkich wykluczonych rekordach należy podać powody wykluczenia.
Pobieranie i sprawdzanie pełnego tekstu
Wiele wyszukiwarek udostępnia bezpłatne łącza do artykułów pełnotekstowych. W przypadku, gdy nie zostanie znaleziony, możemy wyszukiwać w niektórych witrynach badawczych jako ResearchGate, które oferują opcję bezpośredniego żądania pełnego tekstu od autorów. Dodatkowo przeglądanie archiwów poszukiwanych czasopism lub kontakt z PI w celu zakupu, jeśli jest dostępny. Podobnie 2–3 recenzentów pracuje samodzielnie, aby zdecydować o dołączonych pełnych tekstach zgodnie z kryteriami kwalifikowalności, podając przyczyny wykluczenia artykułów. W przypadku jakichkolwiek nieporozumień ostateczna decyzja musi zostać podjęta w drodze dyskusji.
Wyszukiwanie ręczne
Należy wyczerpać wszystkie możliwości zmniejszenia stronniczości, wykonując jawne ręczne wyszukiwanie pobieranie raportów, które mogły zostać usunięte z pierwszego wyszukiwania. Do wyszukiwania ręcznego stosujemy pięć metod: wyszukiwanie referencji z włączonych badań / recenzji, kontaktowanie się z autorami i ekspertami oraz przeglądanie powiązanych artykułów / cytowanych artykułów w PubMed i Google Scholar.
Opisujemy tutaj trzy następujące po sobie metody zwiększyć i udoskonalić wydajność wyszukiwania ręcznego: po pierwsze, przeszukiwanie list referencyjnych zawartych artykułów; po drugie, przeprowadzenie tak zwanego śledzenia cytowań, w którym recenzenci śledzą wszystkie artykuły cytujące każdy z uwzględnionych artykułów, co może obejmować elektroniczne przeszukiwanie baz danych; i po trzecie, podobnie jak w przypadku śledzenia cytowań, śledzimy wszystkie artykuły „powiązane z” lub „podobne”. Każda z powyższych metod może być wykonywana przez 2–3 niezależnych recenzentów, a wszystkie ewentualne istotne artykuły muszą zostać poddane dalszej kontroli pod kątem kryteriów włączenia, po prześledzeniu tych samych zapisów pochodzących z elektronicznych baz danych, tj. Tytuł / streszczenie i przegląd pełnotekstowy .
Proponujemy niezależną ocenę poprzez przypisanie każdemu członkowi zespołu „tagu” i odrębnej metody, w celu zebrania wszystkich wyników na końcu w celu porównania różnic i dyskusji oraz maksymalizacji wyszukiwania i minimalizacji odchylenie. Podobnie, liczbę włączonych artykułów należy podać przed dodaniem do wszystkich zawartych rekordów.
Ekstrakcja danych i ocena jakości
Ten krok upoważnia do zbierania danych z włączonych pełnych teksty w ustrukturyzowanym arkuszu wyodrębniania w programie Excel, który był wcześniej testowany pilotażowo pod kątem ekstrakcji przy użyciu niektórych badań losowych. Zalecamy wyodrębnianie zarówno skorygowanych, jak i nieskorygowanych danych, ponieważ daje to największy dopuszczalny czynnik zakłócający do użyto w analizie, łącząc je później. Proces wydobycia powinien być wykonywany przez 2–3 niezależnych recenzentów. Przeważnie arkusz jest podzielony na charakterystykę badania i charakterystykę pacjenta, wyniki i narzędzie do oceny jakości (QA).
Dane przedstawione na wykresach powinny zostać wyodrębnione za pomocą narzędzi programowych, takich jak digitizer wykresów internetowych. Większość równań, które można wykorzystać w ekstrakcji przed analizą i oszacowaniem odchylenia standardowego (SD) z innych zmiennych, znajduje się w Dodatkowym pliku 5: Plik S2 z odniesieniami jak Hozo et al. , Xiang i in. oraz Rijkom i in. . W zależności od projektu dostępne są różnorodne narzędzia do kontroli jakości: ROB-2 Cochrane narzędzie do randomizowanych badań kontrolowanych, które jest przedstawione jako Dodatkowy plik 1: Rysunek S1 i Dodatkowy plik 2: Rysunek S2 — z danych z poprzedniego opublikowanego artykułu—, Narzędzie NIH do badań obserwacyjnych i przekrojowych, narzędzie ROBINS-I do badań nierandomizowanych, narzędzie QUADAS-2 do badań diagnostycznych, narzędzie QUIPS do badań prognostycznych, narzędzie CARE do opisów przypadków oraz ToxRtool do badań in vivo i in vitro. Zalecamy, aby 2-3 recenzentów niezależnie oceniało jakość badań i dodawało je do formularza ekstrakcji danych przed włączeniem do analizy, aby zmniejszyć ryzyko błędu systematycznego. W narzędziu NIH do badań obserwacyjnych – kohortowych i przekrojowych – tak jak w tym przypadku EBOLA, aby ocenić ryzyko błędu, recenzenci powinni ocenić każdą z 14 pozycji jako zmienne dychotomiczne: tak, nie lub nie dotyczy. Ogólny wynik jest obliczany poprzez dodanie wszystkich wyników pozycji, ponieważ tak równa się jeden, podczas gdy nie i NA równa się zero.Każda praca zostanie poddana punktacji, aby sklasyfikować je jako słabe, dostatecznie dobre lub dobrze przeprowadzone badania, gdzie wynik od 0 do 5 został uznany za słaby, od 6 do 9 za zadowalający, a od 10 do 14 za dobry.
W powyższym przykładzie EBOLA autorzy mogą wyodrębnić następujące informacje: nazwiska autorów, kraj pacjentów, rok publikacji, projekt badania (opis przypadku, badanie kohortowe lub badanie kliniczne lub RCT), wielkość próby, punkt zakażenia czasu od zakażenia EBOLA, odstępu czasu obserwacji po szczepieniu, skuteczności, bezpieczeństwa, działań niepożądanych po szczepieniach i arkusza kontroli jakości (plik dodatkowy 6: Dane S1).
Sprawdzanie danych
Ze względu na spodziewany błąd ludzki i uprzedzenia, zalecamy krok sprawdzania danych, w którym każdy zawarty artykuł jest porównywany z jego odpowiednikiem w arkuszu ekstrakcji za pomocą zdjęć dowodowych, aby wykryć błędy w danych. Zalecamy przydzielanie artykułów 2–3 niezależnym recenzentom, najlepiej nie tym, którzy dokonali ekstrakcji tych artykułów. Gdy zasoby są ograniczone, każdemu recenzentowi przypisuje się inny artykuł niż ten, który wyodrębnił na poprzednim etapie.
Analiza statystyczna
Badacze używają różnych metod łączenia i podsumowywania wyników zawartych badań . Przed analizą wykonywany jest ważny krok zwany czyszczeniem danych w arkuszu ekstrakcyjnym, w którym analityk organizuje dane arkusza ekstrakcyjnego w formie, która może być odczytana przez oprogramowanie analityczne. Analiza składa się z 2 rodzajów: analizy jakościowej i ilościowej. Analiza jakościowa opisuje głównie dane z badań SR, podczas gdy analiza ilościowa składa się z dwóch głównych typów: MA i metaanalizy sieci (NMA). Podgrupy, wrażliwość, analizy kumulacyjne i metaregresja są odpowiednie do testowania, czy wyniki są spójne, czy nie, oraz do badania wpływu pewnych czynników zakłócających na wynik i znajdowania najlepszych predyktorów. Należy ocenić stronniczość publikacji, aby zbadać obecność brakujących badań, które mogą wpłynąć na podsumowanie.
Aby zilustrować podstawową metaanalizę, podajemy wyimaginowane dane do pytania badawczego dotyczącego bezpieczeństwa szczepionek przeciw wirusowi ebola (pod względem zdarzeń, 14 dni po wstrzyknięciu) i immunogenności (wzrost przeciwciał wirusa Ebola w średnim geometrycznym miano, 6 miesięcy po wstrzyknięciu). Zakładając, że na podstawie wyszukiwania i ekstrakcji danych zdecydowaliśmy się przeprowadzić analizę w celu oceny bezpieczeństwa i immunogenności szczepionki „A” szczepionki Ebola. Inne szczepionki przeciwko wirusowi Ebola nie zostały poddane metaanalizie ze względu na ograniczoną liczbę badań (zamiast tego zostaną uwzględnione w recenzji Wyimaginowane dane do metaanalizy bezpieczeństwa szczepionek są dostępne w Dodatkowym pliku 7: Dane S2. Aby przeprowadzić metaanalizę, możemy użyć bezpłatnego oprogramowania, takiego jak RevMan lub meta-pakiet R. W tym przykładzie użyjemy meta pakietu R. Samouczek dotyczący metapakietu jest dostępny za pośrednictwem samouczka PDF „Pakiet ogólny dla meta-analizy”. Kody R i wskazówki dotyczące przeprowadzonej metaanalizy można znaleźć w Dodatkowym pliku 5: Plik S3.
Na potrzeby analizy zakładamy, że badanie ma charakter heterogeniczny; dlatego wybieramy losowy model efektu. Przeprowadziliśmy analizę bezpieczeństwa szczepionki Ebola A. Z tabeli danych możemy zobaczyć pewne zdarzenia niepożądane występujące po domięśniowym wstrzyknięciu szczepionki A badanemu. Załóżmy, że uwzględnimy sześć badań, które spełniają nasze kryteria włączenia. Możemy przeprowadzić metaanalizę dla każdego zdarzenia niepożądanego wyodrębnionego z badań, na przykład bóle stawów, z wyników metaanalizy efektów losowych za pomocą pakietu meta R.
Z wyników przedstawionych w Dodatkowy plik 3: Rysunek S3, widzimy, że iloraz szans (OR) bólu stawów wynosi 1,06 (0,79; 1,42), wartość p = 0,71, co oznacza, że nie ma związku między domięśniowym wstrzyknięciem szczepionki Ebola A a bólem stawów, ponieważ OR jest prawie jeden, a poza tym wartość P jest nieistotna, ponieważ wynosi > 0,05.
W metaanalizie możemy również zwizualizować daje w wyniku działkę leśną. Na ryc. 3 pokazano przykład poletka leśnego z analizy symulowanej.
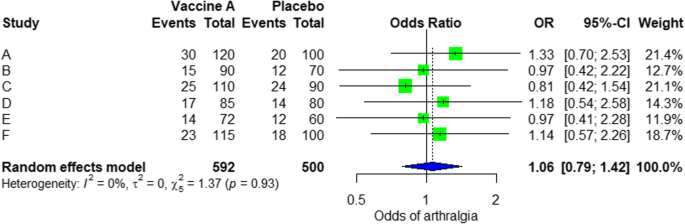
Wykres leśny z losowym efektem dla porównania szczepionki A i placebo
Na powierzchni leśnej możemy zobaczyć sześć badań (od A do F) i odpowiadające im OR (95% CI) . Zielone pudełko przedstawia wielkość efektu (w tym przypadku OR) każdego badania. Im większe pole, tym większe znaczenie badania (tj. Większa wielkość próby). Kształt niebieskiego rombu przedstawia połączone OR z sześciu badań. Widzimy, że niebieski romb przecina pionową linię OR = 1, co wskazuje na brak znaczenia dla skojarzenia, ponieważ diament jest prawie wyrównany po obu stronach. Możemy to potwierdzić również na podstawie 95% przedziału ufności, który obejmuje jeden i wartość p > 0,05.
Jeśli chodzi o niejednorodność, widzimy, że I2 = 0%, co oznacza, że nie wykryto żadnej heterogeniczności; badanie jest stosunkowo jednorodne (rzadko w prawdziwym badaniu). Aby ocenić błąd publikacji związany z metaanalizą działań niepożądanych bólów stawów, możemy wykorzystać funkcję metabiasów z pakietu R (Dodatkowy plik 4: Rysunek S4) i wizualizację za pomocą wykresu lejkowego. Wyniki błędu publikacji przedstawiono na rys. 4. Widzimy, że wartość p związana z tym testem wynosi 0,74, co wskazuje na symetrię wykresu lejkowego. Możemy to potwierdzić, patrząc na wykres lejka.
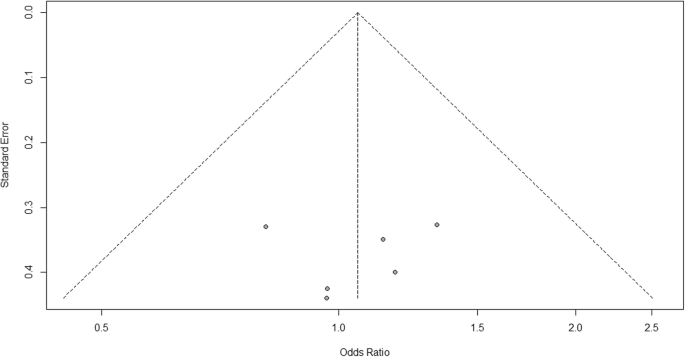
Wykres błędu publikacji dla porównania szczepionki A i placebo
Patrząc na wykres lejka, liczba badań po lewej i prawej stronie wykresu lejka jest taka sama; dlatego wykres jest symetryczny, co wskazuje, że nie wykryto błędu publikacji.
Analiza wrażliwości to procedura używana do odkrywania, jak różne wartości zmiennej niezależnej wpłyną na znaczenie konkretnej zmiennej zależnej poprzez usunięcie jednego badania z MA . Jeśli wszystkie uwzględnione wartości p badania wynoszą < 0,05, zatem usunięcie dowolnego badania nie zmieni istotnego związku. Przeprowadza się ją tylko wtedy, gdy istnieje istotny związek, więc jeśli wartość p wykonanego MA wynosi 0,7 – więcej niż jeden – analiza wrażliwości nie jest potrzebna w tym przykładzie studium przypadku. Jeśli istnieją 2 badania z wartością p > 0,05, usunięcie któregokolwiek z tych dwóch badań spowoduje utratę istotności.
Podwójne sprawdzanie danych
Aby uzyskać większą pewność co do jakości wyników, przeanalizowane dane należy ponownie porównać z danymi pełnotekstowymi za pomocą zdjęć dowodowych, aby umożliwić oczywiste sprawdzenie kierownika badania.
Pisanie manuskryptu, weryfikacja i przesłanie do czasopisma
Pisanie oparte na czterech sekcjach naukowych: wprowadzenie, metody, wyniki i dyskusja, głównie z podsumowaniem. Wykonanie charakterystycznej tabeli dla badania i charakterystyki pacjenta jest obowiązkowym krokiem, który można znaleźć jako szablon w Dodatkowym pliku 5: Tabela S3.
Po zakończeniu pisania manuskryptu, tabeli charakterystyk i diagramu przepływu PRISMA, zespół powinien wysłać go do dyrektora generalnego, aby dobrze go poprawił i odpowiedział na jego uwagi, a na koniec wybrać odpowiednie czasopismo dla manuskryptu, które odpowiada znacznemu wpływowi i pasowaniu. Musimy zwrócić uwagę, czytając wytyczne dla autorów czasopism przed przesłaniem manuskryptu.
