Ley de Charles
El físico francés Jacques Charles (1746 – 1823) estudió el efecto de la temperatura sobre el volumen de un gas a presión constante. La ley de Charles establece que el volumen de una masa dada de gas varía directamente con la temperatura absoluta del gas cuando la presión se mantiene constante. La temperatura absoluta es la temperatura medida con la escala Kelvin. Se debe usar la escala Kelvin porque cero en la escala Kelvin corresponde a una parada completa del movimiento molecular.
Matemáticamente, la relación directa de la ley de Charles se puede representar mediante la siguiente ecuación:
\
Al igual que con la ley de Boyle, \ (k \) es constante solo para una muestra de gas determinada. La siguiente tabla muestra los datos de temperatura y volumen para una cantidad determinada de gas a presión constante. La tercera columna es la constante para este conjunto de datos en particular y siempre es igual al volumen dividido por la temperatura Kelvin.
Cuando se grafican estos datos, el resultado es una línea recta, indicativa de una relación directa, se muestra en la figura siguiente.
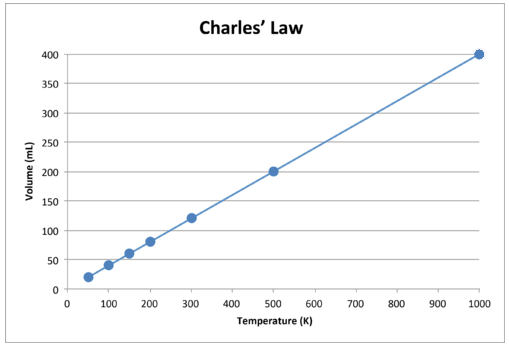
Figura \ (\ PageIndex {2} \): El volumen de un gas aumenta a medida que la temperatura Kelvin aumenta.
Observe que la línea va exactamente hacia el origen, lo que significa que cuando la temperatura absoluta del gas se acerca a cero, su volumen se acerca a cero. Sin embargo, cuando un gas se lleva a temperaturas extremadamente frías, sus moléculas eventualmente se condensarían en el estado líquido antes de alcanzar el cero absoluto. La temperatura a la que se produce este cambio al estado líquido varía para diferentes gases.
\
Esta ecuación se puede utilizar para calcular cualquiera de las cuatro cantidades si se conocen las otras tres . La relación directa solo se mantendrá si las temperaturas se expresan en Kelvin. Las temperaturas en grados Celsius no funcionarán. Recuerde la relación que \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
