Charlesův zákon
Francouzský fyzik Jacques Charles (1746 – 1823) studoval vliv teploty na objemu plynu při konstantním tlaku. Charlesův zákon uvádí, že objem dané hmotnosti plynu se mění přímo s absolutní teplotou plynu, když je tlak udržován konstantní. Absolutní teplota je teplota měřená Kelvinovou stupnicí. Je nutné použít Kelvinovu stupnici, protože nula na Kelvinově stupnici odpovídá úplnému zastavení molekulárního pohybu.
Matematicky lze přímý vztah Charlesova zákona vyjádřit následující rovnicí:
\
Stejně jako u Boyleova zákona je \ (k \) konstantní pouze pro daný vzorek plynu. Níže uvedená tabulka zobrazuje údaje o teplotě a objemu pro nastavené množství plynu při konstantním tlaku. Třetí sloupec je konstanta pro tento konkrétní soubor dat a vždy se rovná objemu dělenému teplotou Kelvina.
Když jsou tato data grafována, výsledkem je přímka, která naznačuje přímý vztah, zobrazeno na obrázku níže.
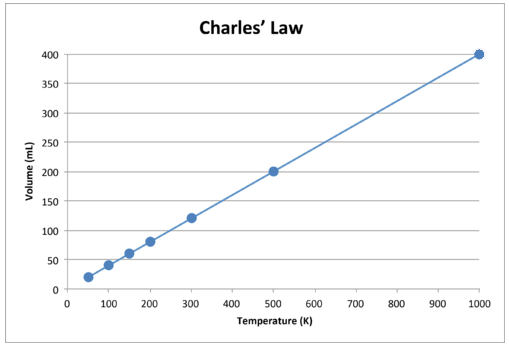
Obrázek \ (\ PageIndex {2} \): Objem plynu se zvyšuje s Kelvinova teplota se zvyšuje.
Všimněte si, že čára jde přesně k počátku, což znamená, že jak se absolutní teplota plynu blíží nule, jeho objem se blíží nule. Když se však plyn uvede na extrémně nízké teploty, jeho molekuly nakonec kondenzují do kapalného stavu, než dosáhnou absolutní nuly. Teplota, při které k této změně do kapalného stavu dochází, se u různých plynů liší.
\
Tuto rovnici lze použít k výpočtu kterékoli ze čtyř veličin, pokud jsou známy další tři . Přímý vztah bude platit, pouze pokud jsou teploty vyjádřeny v Kelvinech. Teploty ve stupních Celsia nebudou fungovat. Vzpomeňte si na vztah, který \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
