Charles ‚Gesetz
Der französische Physiker Jacques Charles (1746 – 1823) untersuchte den Einfluss der Temperatur über das Volumen eines Gases bei konstantem Druck. Das Charles’sche Gesetz besagt, dass das Volumen einer gegebenen Gasmasse direkt mit der absoluten Temperatur des Gases variiert, wenn der Druck konstant gehalten wird. Die absolute Temperatur ist die mit der Kelvin-Skala gemessene Temperatur. Die Kelvin-Skala muss verwendet werden, da Null auf der Kelvin-Skala einer vollständigen Unterbrechung der molekularen Bewegung entspricht.
Mathematisch kann die direkte Beziehung von Charles ‚Gesetz durch die folgende Gleichung dargestellt werden:
\
Wie beim Boyle’schen Gesetz ist \ (k \) nur für eine gegebene Gasprobe konstant. Die folgende Tabelle zeigt Temperatur- und Volumendaten für eine festgelegte Gasmenge bei konstantem Druck. Die dritte Spalte ist die Konstante für diesen bestimmten Datensatz und entspricht immer dem Volumen geteilt durch die Kelvin-Temperatur.
Wenn diese Daten grafisch dargestellt werden, ist das Ergebnis eine gerade Linie, die auf eine direkte Beziehung hinweist. Dies ist in der folgenden Abbildung dargestellt.
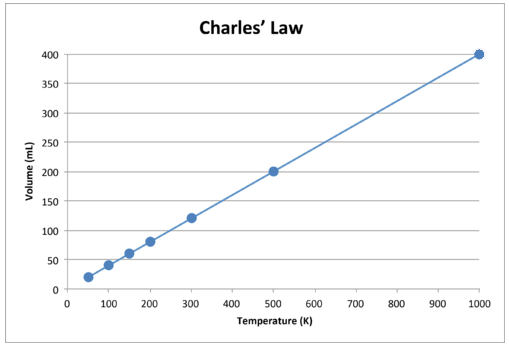
Abbildung \ (\ PageIndex {2} \): Das Volumen eines Gases nimmt zu als Die Kelvin-Temperatur steigt an.
Beachten Sie, dass die Linie genau in Richtung des Ursprungs verläuft, was bedeutet, dass wenn sich die absolute Temperatur des Gases Null nähert, sich sein Volumen Null nähert. Wenn ein Gas jedoch auf extrem kalte Temperaturen gebracht wird, kondensieren seine Moleküle schließlich in den flüssigen Zustand, bevor sie den absoluten Nullpunkt erreichen. Die Temperatur, bei der dieser Wechsel in den flüssigen Zustand auftritt, variiert für verschiedene Gase.
\
Diese Gleichung kann verwendet werden, um eine der vier Größen zu berechnen, wenn die anderen drei bekannt sind . Die direkte Beziehung gilt nur, wenn die Temperaturen in Kelvin ausgedrückt werden. Temperaturen in Celsius funktionieren nicht. Erinnern Sie sich an die Beziehung, die \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
