Charles’s Law
Fransk fysiker Jacques Charles (1746 – 1823) studerade effekten av temperatur på volymen av en gas vid konstant tryck. Charles lag säger att volymen för en given massa gas varierar direkt med gasens absoluta temperatur när trycket hålls konstant. Den absoluta temperaturen är temperaturen mätt med Kelvin-skalan. Kelvin-skalan måste användas eftersom noll på Kelvin-skalan motsvarar ett fullständigt stopp av molekylär rörelse.
Matematiskt kan det direkta förhållandet mellan Charles lag representeras av följande ekvation:
\
Som med Boyles lag är \ (k \) konstant endast för ett givet gasprov. Tabellen nedan visar temperatur- och volymdata för en bestämd mängd gas vid ett konstant tryck. Den tredje kolumnen är konstanten för denna speciella datamängd och är alltid lika med volymen dividerad med Kelvin-temperaturen.
När dessa data är ritade är resultatet en rak linje, vilket indikerar en direkt relation, visas i figuren nedan.
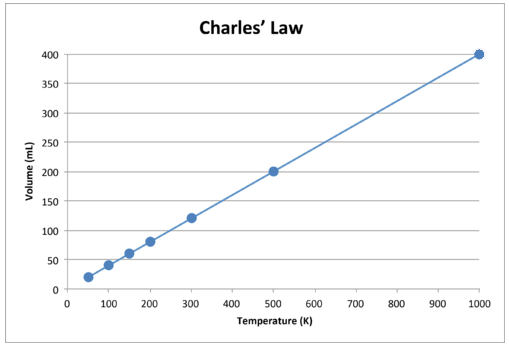
Figur \ (\ PageIndex {2} \): Volymen på en gas ökar när Kelvin-temperaturen ökar.
Lägg märke till att linjen går exakt mot ursprunget, vilket betyder att när den absoluta temperaturen för gasen närmar sig noll, når dess volym noll. Men när en gas bringas till extremt kalla temperaturer skulle dess molekyler så småningom kondensera till flytande tillstånd innan de nådde absolut noll. Temperaturen vid vilken denna förändring i flytande tillstånd inträffar varierar för olika gaser.
\
Denna ekvation kan användas för att beräkna vilken som helst av de fyra kvantiteterna om de andra tre är kända . Det direkta förhållandet kommer endast att gälla om temperaturerna uttrycks i Kelvin. Temperaturer i Celsius fungerar inte. Kom ihåg förhållandet som \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
