Legea lui Charles
Fizicianul francez Jacques Charles (1746 – 1823) a studiat efectul temperaturii asupra volumului unui gaz la presiune constantă.Legea lui Charles afirmă că volumul unei mase date de gaz variază direct cu temperatura absolută a gazului când presiunea este menținută constantă. Temperatura absolută este temperatura măsurată cu scara Kelvin. Scara Kelvin trebuie utilizată deoarece zero pe scara Kelvin corespunde unei opriri complete a mișcării moleculare.
Matematic, relația directă a Legii lui Charles poate fi reprezentată de următoarea ecuație:
\
La fel ca în legea lui Boyle, \ (k \) este constantă numai pentru o probă de gaz dată. Tabelul de mai jos prezintă datele privind temperatura și volumul pentru o cantitate stabilită de gaz la o presiune constantă. A treia coloană este constanta pentru acest set de date și este întotdeauna egală cu volumul împărțit la temperatura Kelvin.
Când aceste date sunt reprezentate grafic, rezultatul este o linie dreaptă, indicativă a unei relații directe, prezentat în figura de mai jos.
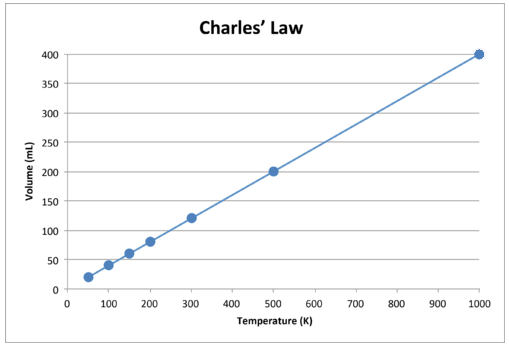
Figura \ (\ PageIndex {2} \): Volumul unui gaz crește pe măsură ce temperatura Kelvin crește.
Observați că linia merge exact spre origine, ceea ce înseamnă că, pe măsură ce temperatura absolută a gazului se apropie de zero, volumul său se apropie de zero. Cu toate acestea, atunci când un gaz este adus la temperaturi extrem de reci, moleculele sale s-ar condensa în cele din urmă în stare lichidă înainte de a ajunge la zero absolut. Temperatura la care se produce această schimbare în stare lichidă variază pentru diferite gaze.
\
Această ecuație poate fi utilizată pentru a calcula oricare dintre cele patru cantități, dacă celelalte trei sunt cunoscute . Relația directă se va menține numai dacă temperaturile sunt exprimate în Kelvin. Temperaturile în Celsius nu vor funcționa. Reamintim relația pe care \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
