Loi de Charles
Le physicien français Jacques Charles (1746 – 1823) a étudié l’effet de la température sur le volume d’un gaz à pression constante. La loi de Charles stipule que le volume d’une masse donnée de gaz varie directement avec la température absolue du gaz lorsque la pression est maintenue constante. La température absolue est la température mesurée avec l’échelle Kelvin. L’échelle Kelvin doit être utilisée car zéro sur l’échelle Kelvin correspond à un arrêt complet du mouvement moléculaire.
Mathématiquement, la relation directe de la loi de Charles peut être représentée par l’équation suivante:
\
Comme pour la loi de Boyle, \ (k \) n’est constant que pour un échantillon de gaz donné. Le tableau ci-dessous présente les données de température et de volume pour une quantité définie de gaz à une pression constante. La troisième colonne est la constante pour cet ensemble de données particulier et est toujours égale au volume divisé par la température Kelvin.
Lorsque ces données sont représentées graphiquement, le résultat est une ligne droite, indiquant une relation directe, illustrée dans la figure ci-dessous.
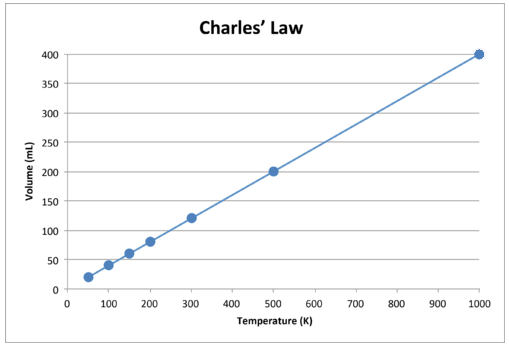
Figure \ (\ PageIndex {2} \): Le volume d’un gaz augmente à mesure que la température Kelvin augmente.
Notez que la ligne se dirige exactement vers l’origine, ce qui signifie que lorsque la température absolue du gaz s’approche de zéro, son volume s’approche de zéro. Cependant, lorsqu’un gaz est porté à des températures extrêmement froides, ses molécules finiraient par se condenser à l’état liquide avant d’atteindre le zéro absolu. La température à laquelle ce changement dans l’état liquide se produit varie pour différents gaz.
\
Cette équation peut être utilisée pour calculer l’une des quatre quantités si les trois autres sont connues . La relation directe ne sera valable que si les températures sont exprimées en Kelvin. Les températures en Celsius ne fonctionneront pas. Rappelez-vous la relation que \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
