Charles’s Law
Den franske fysiker Jacques Charles (1746 – 1823) studerede effekten af temperatur på volumenet af en gas ved konstant tryk. Charles lov siger, at volumenet af en given gasmasse varierer direkte med gasens absolutte temperatur, når trykket holdes konstant. Den absolutte temperatur er temperatur målt med Kelvin-skalaen. Kelvin-skalaen skal bruges, fordi nul på Kelvin-skalaen svarer til en fuldstændig afbrydelse af molekylær bevægelse.
Matematisk kan Karls lovs direkte forhold repræsenteres ved følgende ligning:
\
Som med Boyles lov er \ (k \) kun konstant for en given gasprøve. Tabellen nedenfor viser temperatur- og volumendata for en indstillet mængde gas ved et konstant tryk. Den tredje kolonne er konstanten for dette bestemte datasæt og er altid lig med lydstyrken divideret med Kelvin-temperaturen.
Når disse data er tegnet, er resultatet en lige linje, der indikerer et direkte forhold, vist i figuren nedenfor.
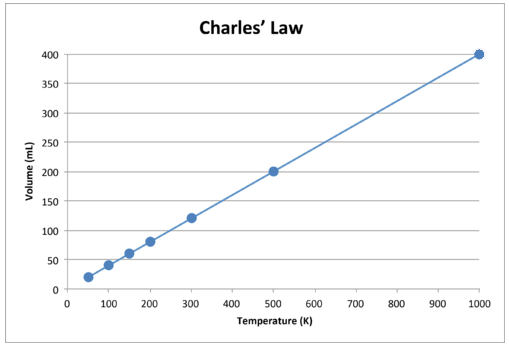
Figur \ (\ PageIndex {2} \): Volumenet af en gas øges som Kelvin-temperaturen stiger.
Bemærk, at linjen går nøjagtigt mod oprindelsen, hvilket betyder, at når den absolutte temperatur for gassen nærmer sig nul, når dens volumen nul. Men når en gas bringes til ekstremt kolde temperaturer, vil dens molekyler til sidst kondensere til flydende tilstand, før de når absolut nul. Den temperatur, ved hvilken denne ændring i flydende tilstand forekommer, varierer for forskellige gasser.
\
Denne ligning kan bruges til at beregne en af de fire størrelser, hvis de andre tre er kendt . Det direkte forhold gælder kun, hvis temperaturerne udtrykkes i Kelvin. Temperaturer i Celsius fungerer ikke. Husk forholdet, der \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
