束一性
蒸気圧降下
物理的性質は2つのカテゴリーに分けることができます。広範な特性(質量や体積など)は、サンプルのサイズによって異なります。示量性と示強性(密度や濃度など)は、物質の特徴的な特性であり、調査対象のサンプルのサイズには依存しません。このセクションでは、システムの集中的なプロパティのサブセットである3番目のカテゴリを紹介します。束一性として知られるこの3番目のカテゴリーは、ソリューションにのみ適用できます。定義によれば、溶液の特性の1つは、溶質の正体ではなく、溶液中の溶質と溶媒の粒子数の比率のみに依存する場合の協調特性です。
ソリューションの物理的特性のほとんどは、協調的特性です。この限られた一連の物理的特性の例として、溶質を加えて溶液を形成すると、溶媒の蒸気圧がどうなるかを考えてみましょう。Poを純粋な液体の蒸気圧として定義します![]() 溶媒
溶媒![]() および溶質を添加した後の溶媒の蒸気圧としてのP。
および溶質を添加した後の溶媒の蒸気圧としてのP。
Po =純粋な液体または溶媒の蒸気圧
P =溶液中の溶媒の蒸気圧
液体の温度が沸点を下回っている場合ポイント、液体から逃げて気体を形成できる分子は、液体の表面近くにある分子だけであると推測できます。
溶質を溶媒に加えると、下の図に示すように、溶質分子の一部が液体の表面近くの空間を占めます。溶質が溶媒に溶解すると、表面近くの溶媒分子の数が減少し、溶媒の蒸気圧が低下します。

これは、気相中の溶媒分子が凝縮して液体を形成する速度には影響しません。しかし、それは液体中の溶媒分子が気相に逃げることができる速度を低下させます。結果として、溶液から逃げる溶媒の蒸気圧は、純粋な溶媒の蒸気圧よりも小さくなければならない。
| P | < | Po | ||
| 蒸気圧 溶媒 溶液の上 |
純粋な溶媒の蒸気圧 |
1887年から1888年の間に、フランソワマリーラウルトは溶液の蒸気圧が溶媒のモル分率に純粋な液体の蒸気圧を掛けたものに等しい。
| P | = | 溶媒Po | ||||
| 蒸気圧 溶媒の 溶液の上 |
純粋な溶媒の蒸気圧 |
ラウールの法則として知られるこの式は理解しやすいです。溶媒が純粋で、溶媒のモル分率が1に等しい場合、PはPoに等しくなります。溶媒のモル分率が小さくなると、 、溶液から逃げる溶媒の蒸気圧も小さくなります。
今のところ、溶媒は、測定可能な蒸気圧を持つのに十分な揮発性を持つ溶液の唯一の成分であると仮定しましょう。これが当てはまる場合、溶液の蒸気圧は、溶液から逃げる溶媒の蒸気圧に等しくなります。ラウールの法則は、純粋な溶媒と溶液の蒸気圧の差は、溶媒のモル分率が減少するにつれて増加することを示唆しています。
溶媒に溶質を添加したときに発生する蒸気圧の変化は次のとおりです。したがって、衝突特性。溶質のモル分率に依存する場合は、溶液中の溶質と溶媒の粒子数の比率に依存する必要がありますが、溶質の正体には依存しません。
![]()
沸騰点の上昇と凝固点の低下
下の図は、溶質が溶媒の蒸気圧を下げるという事実の結果を示しています。固体この相図の点BとCを結ぶ線には、純粋な溶媒とその蒸気が平衡状態になる温度と圧力の組み合わせが含まれています。したがって、この線の各点は、その温度での純粋な溶媒の蒸気圧を表します。この図の点線は、特性を示しています。溶質を溶媒に溶解して得られた溶液のes。任意の温度で、溶液から逃げる溶媒の蒸気圧は、純粋な溶媒の蒸気圧よりも小さくなります。したがって、点線は実線の下にあります。
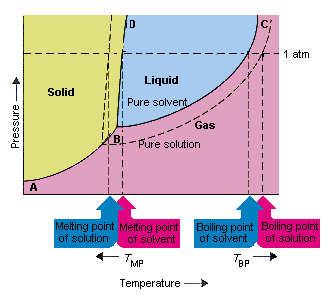
溶質を溶媒に加えるときに発生する溶媒の蒸気圧は、溶液の沸点を上昇させ、融点を低下させます。
この図によると、溶液は純粋な溶媒と同じ温度で沸騰することはできません。溶液から逃げる溶媒は、任意の温度で純粋な溶媒の蒸気圧よりも小さいため、溶液を沸騰させる前に、溶液をより高い温度に加熱する必要があります。したがって、溶液を形成するために使用されるときに発生する溶媒の蒸気圧の低下。液体の沸騰点を上げます。
位相図が導入されたとき、三重点は、気体、液体、および固体が同時に存在できる温度と圧力の唯一の組み合わせとして定義されました。上の図は、溶液の三重点は、純粋な溶媒の三重点よりも低い温度で発生します。三重点の変化自体は重要ではありませんが、溶液が凍結または溶融する温度が変化します。理解するにはなぜ、私たちは注意を払わなければなりません状態図の固体領域と液体領域を分離する線で完全に。物質の融点は圧力にあまり敏感ではないため、この線はほぼ垂直です。
溶質を溶媒に追加しても、融点が圧力に依存する方法は変わりません。したがって、溶液の固体領域と液体領域を分離する線は、純粋な溶媒に対して同じ機能を果たす線と平行になります。ただし、この線は溶液の三重点を通過する必要があります。したがって、溶質が溶媒に溶解したときに発生する三重点の減少は、溶液の融点を低下させます。
上の図は、溶質が溶媒に溶解するときに発生する蒸気圧の変化は、溶媒の融点と沸点の変化にもつながります。蒸気圧の変化は、溶質と溶媒粒子の相対的な数にのみ依存する協調特性であるためです。 、溶媒の沸点と融点の変化も衝突特性です。
![]()
衝突特性の計算
悪魔への最良の方法束一性の重要性は、ラウールの法則の結果を調べることです。 Raoultは、溶液から逃げる溶媒の蒸気圧が溶媒のモル分率に比例することを発見しました。
P = CsolventPo
しかし、溶媒の蒸気圧は共同特性ではありません。溶液の束一性には、溶質を溶媒に加えたときに発生する蒸気圧の変化のみを含めることができます。
圧力は状態関数であるため、溶質を溶媒に添加したときに発生する溶媒の蒸気圧の変化は、純粋な溶媒の蒸気圧と溶媒の蒸気圧の差として定義できます。ソリューションからの脱出。
P = Po-P
この方程式にラウールの法則を代入すると、次の結果が得られます。
P = Po-Csolvent Po =(1-Csolvent) Po
この方程式は、溶質のモル分率と溶媒のモル分率の関係を覚えておくことで簡略化できます。
Csolute + Csolvent = 1
これを代入しますPgivesを定義する方程式への関係は、ラウールの法則の別の形式です。
P = CsolutePo
この式は、溶質を溶媒に添加したときに発生する溶媒の蒸気圧の変化が、溶質のモル分率に比例することを示しています。より多くの溶質が溶媒に溶解するにつれて、溶媒の蒸気圧は低下し、溶媒の蒸気圧の変化は増加します。
溶質を溶媒に添加したときに発生する溶媒の沸点(TBP)の変化は、溶媒の蒸気圧の変化に起因するため、沸点の変化の大きさも比例します。溶質のモル分率に。
![]() TBP = kbsolute
TBP = kbsolute
希薄溶液では、溶質のモル分率は、に示すように、溶液のモル濃度に比例します。下の図。

したがって、溶質を溶媒に加えたときに発生する沸点上昇の大きさを表す式は、次のように記述されることがよくあります。
![]() TBP = kbm
TBP = kbm
ここで、![]() TBPは沸点上昇です-溶質が溶媒に溶解するときに発生する沸点の変化
TBPは沸点上昇です-溶質が溶媒に溶解するときに発生する沸点の変化![]() およびkbは、溶媒のモル沸点上昇定数として知られる比例定数です。
およびkbは、溶媒のモル沸点上昇定数として知られる比例定数です。
同様の方程式を記述して、溶質を溶媒に添加したときに溶媒の凝固点(または融点)がどうなるかを説明できます。
![]() TFP = -kfm
TFP = -kfm
この式では、![]() TFPが凝固点です。凝固点降下
TFPが凝固点です。凝固点降下![]() 溶質が溶媒に溶解するときに発生する凝固点の変化、および溶媒のモル凝固点降下定数をkfisします。この式では、溶質を添加すると溶媒の凝固点が低下することを示すために負の符号が使用されています。
溶質が溶媒に溶解するときに発生する凝固点の変化、および溶媒のモル凝固点降下定数をkfisします。この式では、溶質を添加すると溶媒の凝固点が低下することを示すために負の符号が使用されています。
kfとkbasの値、およびいくつかの純粋な溶媒の凝固点と沸点を以下の表に示します。
凝固点降下定数
沸点上昇定数
練習問題6:
35.5グラムの硫黄が100.0グラムのCS2に溶解して、49.48oCの沸点を持つ溶液を生成する場合、硫黄の分子量を計算します。
練習問題6の回答を確認するにはここをクリック
練習問題6の解決策を確認するにはここをクリック
練習問題7:
30.0グラムの酢酸を含む溶液の場合、酢酸の分子量を決定します。キログラムの水は-0.93oCで凍結します。これらの結果は、酢酸の化学式がCH3CO2Hであるという仮定と一致していますか?
練習問題7の回答を確認するにはここをクリック
練習問題7の解決策を確認するにはここをクリック
練習問題7の計算で、塩酸などのより強い酸を使用して何が繰り返されましたか?
練習問題8:
ベンゼンに溶解した0.100mのHCl溶液の凝固点降下が0.512oCであるのに対し、水中の0.100mのHCl溶液の凝固点降下が0.352oCである理由を説明します。
練習問題8に対する回答を確認するには、ここをクリックしてください
1884年にJacobusHenricus van “tホフは、凝固点降下と沸点上昇の式に別の用語を導入して、水に溶解すると解離する化合物の溶液の束一性を説明しました。
![]() TFP =- kf(i)m
TFP =- kf(i)m
0.100 m HCl溶液の凝固点降下の実験値をこの式に代入すると、i項の値は1.89になります。HClが水中で解離しなかった場合、iは1になります。完全に解離する場合、私は2になります。1.89の実験値は、この溶液でHCl分子の少なくとも95%が解離することを示唆しています。
実践問題9:
0.60グラムの酢酸が200グラムのベンゼンに溶解して溶液を形成し、ベンゼンの凝固点を5.40oCに下げる理由を説明してください。
ここをクリックして回答を確認してください。練習問題9
![]()
浸透圧
1784年、フランスの物理学者で牧師のジャンアントワーヌノレットは、アルコールの濃縮溶液で満たされたブタの膀胱が水に浸されると膨張することを発見しました。ブラダーは半透膜として機能し、水分子が溶液に入るのを可能にしましたが、アルコール分子が反対方向に移動するのを防ぎました。溶液を希釈するために膜を通過する溶液の1つの成分の移動は浸透圧と呼ばれ、これが生成する圧力は浸透圧と呼ばれます()。
浸透圧は、下の図に示す装置で実証できます。半透膜は、アザミ管の開放端を横切って結ばれています。次に、チューブを砂糖またはアルコールの水溶液で部分的に満たし、水のビーカーに浸します。重力による水柱への圧力が膜を介して水を駆動する浸透圧と釣り合うまで、水はチューブに流れ込みます。

水が流れる半透膜は、この溶液のカラムを引き下げる重力が浸透圧と釣り合うまでアルコール溶液を希釈し、水を膜に押し込みます。
ラウールが溶液の蒸気圧と純粋な溶媒の蒸気圧の関係を発見したのと同じ年、ヤコブスヘンリカスvan “t Hoffは、希薄溶液の浸透圧()が理想気体方程式に類似した方程式に従っていることを発見しました。
| |
= | nRT | ||
| V |
この式は、浸透圧が衝突特性のもう1つの例であることを示しています。圧力は、溶質粒子の数と溶液の体積の比率![]() n / V
n / V ![]() に依存し、溶質粒子の正体には依存しません。また、浸透圧の大きさを思い出させます。この式によれば、1.00 M s olutionの浸透圧は0oCで22.4atmです。
に依存し、溶質粒子の正体には依存しません。また、浸透圧の大きさを思い出させます。この式によれば、1.00 M s olutionの浸透圧は0oCで22.4atmです。

これは、1.00 Mのソリューションで、高さ670インチ(約56フィート)の水柱をサポートできる必要があることを意味します。 !!
生物学者や生化学者は、細胞の成分を分離するときに浸透圧を利用することがよくあります。細胞内の液体よりもはるかに高濃度のイオンを含む水溶液に細胞を加えると、細胞が収縮して膜が破壊されるまで、水が細胞膜を流れることによって細胞を離れます。あるいは、イオン強度がはるかに小さい溶液に細胞を入れると、水が細胞に注がれ、細胞膜が破裂するまで細胞が膨張します。
![]()
