Właściwości koligatywne
Spadek ciśnienia pary
Właściwości fizyczne można podzielić na dwie kategorie. Rozległe właściwości (takie jak masa i objętość) zależą od wielkości próbki. Intensywne właściwości (takie jak gęstość i stężenie) są właściwościami charakterystycznymi substancji; nie zależą one od wielkości badanej próbki. Ta sekcja wprowadza trzecią kategorię, która jest podzbiorem intensywnych właściwości systemu. Tę trzecią kategorię, znaną jako właściwości koligatywne, można zastosować tylko do rozwiązań. Z definicji, jedną z właściwości roztworu jest właściwość koligatywna, jeśli zależy tylko od stosunku liczby cząstek substancji rozpuszczonej do rozpuszczalnika w roztworze, a nie od tożsamości substancji rozpuszczonej.
Bardzo niewiele fizycznych właściwości roztworu to właściwości kolektywne. Jako przykład tego ograniczonego zestawu właściwości fizycznych, zastanówmy się, co dzieje się z ciśnieniem par rozpuszczalnika, gdy dodamy substancję rozpuszczoną w celu utworzenia roztworu. Zdefiniujemy Po jako ciśnienie pary czystej cieczy ![]() rozpuszczalnik
rozpuszczalnik ![]() i P jako ciśnienie pary rozpuszczalnika po dodaniu substancji rozpuszczonej.
i P jako ciśnienie pary rozpuszczalnika po dodaniu substancji rozpuszczonej.
Po = ciśnienie pary czystej cieczy lub rozpuszczalnika
P = ciśnienie pary rozpuszczalnika w roztworze
Gdy temperatura cieczy jest niższa od temperatury wrzenia punkt, możemy założyć, że jedynymi cząsteczkami, które mogą uciec z cieczy, tworząc gaz, są te, które znajdują się w pobliżu powierzchni cieczy.
Gdy do rozpuszczalnika dodaje się substancję rozpuszczoną, niektóre cząsteczki rozpuszczone zajmują przestrzeń w pobliżu powierzchni cieczy, jak pokazano na poniższym rysunku. Gdy substancja rozpuszczona jest rozpuszczona w rozpuszczalniku, liczba cząsteczek rozpuszczalnika w pobliżu powierzchni zmniejsza się, a ciśnienie pary rozpuszczalnika spada.

Nie ma to wpływu na szybkość, z jaką cząsteczki rozpuszczalnika w fazie gazowej kondensują się, tworząc ciecz. Ale obniża temperaturę, przy której cząsteczki rozpuszczalnika w cieczy mogą przedostać się do fazy gazowej. W rezultacie ciśnienie pary rozpuszczalnika ulatniającego się z roztworu powinno być mniejsze niż ciśnienie pary czystego rozpuszczalnika.
| P | < | Po | ||
| ciśnienie pary rozpuszczalnik nad roztworem |
prężność par czystego rozpuszczalnika |
W latach 1887-1888 Francois-Marie Raoult wykazał, że ciśnienie pary roztworu jest równa ułamkowi molowemu rozpuszczalnika razy ciśnienie pary czystej cieczy.
| P | = | Csolvent Po | ||||
| ciśnienie pary rozpuszczalnika nad roztworem |
prężność pary czystego rozpuszczalnika |
To równanie, znane jako prawo Raoulta, jest łatwe do zrozumienia. Kiedy rozpuszczalnik jest czysty, a frakcja molowa rozpuszczalnika jest równa 1, P jest równe Po. Gdy ułamek molowy rozpuszczalnika zmniejsza się , ciśnienie par rozpuszczalnika wydostającego się z roztworu również będzie mniejsze.
Załóżmy na chwilę, że rozpuszczalnik jest jedynym składnikiem roztworu, który jest na tyle lotny, aby mieć łatwą do określenia prężność pary. Jeśli to prawda, prężność par roztworu będzie równa prężności par rozpuszczalnika uciekającego z roztworu. Prawo Raoulta sugeruje, że różnica między prężnością pary czystego rozpuszczalnika a roztworem zwiększa się wraz ze spadkiem ułamka molowego rozpuszczalnika.
Zmiana prężności pary, która występuje po dodaniu substancji stałej do rozpuszczalnika, wynosi w związku z tym właściwość koligatywna. Jeśli zależy to od ułamka molowego substancji rozpuszczonej, to musi zależeć od stosunku liczby cząstek substancji rozpuszczonej do rozpuszczalnika w roztworze, ale nie od tożsamości substancji rozpuszczonej.
![]()
Podniesienie temperatury wrzenia i obniżenie temperatury krzepnięcia
Poniższy rysunek przedstawia konsekwencje faktu, że substancje rozpuszczone obniżają ciśnienie pary rozpuszczalnika. punkty połączenia B i C na tym wykresie fazowym zawierają kombinacje temperatury i ciśnienia, przy których czysty rozpuszczalnik i jego opary są w równowadze. Dlatego każdy punkt na tej linii opisuje ciśnienie pary rozpuszczalnika w tej temperaturze. Linia przerywana na tym rysunku opisuje właściwości es roztworu otrzymanego przez rozpuszczenie substancji stałej w rozpuszczalniku.W dowolnej temperaturze ciśnienie pary rozpuszczalnika uciekającego z roztworu jest mniejsze niż ciśnienie pary czystego rozpuszczalnika. Dlatego linia przerywana leży poniżej linii ciągłej.
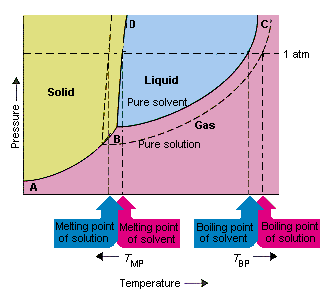
Spadek ciśnienie pary rozpuszczalnika, które występuje, gdy substancja rozpuszczona jest dodawana do rozpuszczalnika, powoduje wzrost temperatury wrzenia i obniżenie temperatury topnienia roztworu.
Zgodnie z tym rysunkiem roztwór nie może wrzeć w tej samej temperaturze co czysty rozpuszczalnik. Jeśli ciśnienie pary rozpuszczalnik uciekający z roztworu jest mniejszy niż ciśnienie pary czystego rozpuszczalnika w dowolnej temperaturze, roztwór należy podgrzać do wyższej temperatury, zanim zacznie wrzeć. obniżenie prężności par rozpuszczalnika, które występuje, gdy jest używany do tworzenia roztworu, dlatego zwiększa temperaturę wrzenia cieczy.
Kiedy wprowadzono wykresy fazowe, punkt potrójny został zdefiniowany jako jedyna kombinacja temperatury i ciśnienia, przy której gaz, ciecz i ciało stałe mogą istnieć w tym samym czasie. Na powyższym rysunku że punkt potrójny roztworu występuje w niższej temperaturze niż punkt potrójny czystego rozpuszczalnika. Sama zmiana punktu potrójnego nie jest ważna. Ale powoduje zmianę temperatury, w której roztwór zamarza lub topi się. Aby zrozumieć dlaczego, musimy uważać w pełni wzdłuż linii, która oddziela obszary stałe i ciekłe na diagramie fazowym. Ta linia jest prawie pionowa, ponieważ temperatura topnienia substancji nie jest bardzo wrażliwa na nacisk.
Dodanie substancji rozpuszczonej do rozpuszczalnika nie zmienia sposobu, w jaki temperatura topnienia zależy od ciśnienia. Linia oddzielająca obszary stałe i ciekłe roztworu jest zatem równoległa do linii, która pełni tę samą funkcję dla czystego rozpuszczalnika . Ta linia musi jednak przechodzić przez punkt potrójny dla roztworu. Spadek punktu potrójnego, który występuje, gdy substancja rozpuszczona jest w rozpuszczalniku, powoduje zatem zmniejszenie temperatury topnienia roztworu.
Powyższy rysunek pokazuje, jak zmiana prężności pary, która występuje, gdy substancja rozpuszcza się w rozpuszczalniku, prowadzi do zmian temperatury topnienia i wrzenia rozpuszczalnika, ponieważ zmiana prężności pary jest właściwością koligatywną, która zależy tylko od względnej liczby cząstek substancji rozpuszczonej i rozpuszczalnika , zmiany temperatury wrzenia i topnienia rozpuszczalnika są również właściwościami koligatywnymi.
![]()
Obliczenia właściwości koligatywnych
Najlepszy sposób na demony Ważnością właściwości koligatywnych jest zbadanie konsekwencji prawa Raoulta. Raoult odkrył, że prężność pary rozpuszczalnika uciekającego z roztworu jest proporcjonalna do ułamka molowego rozpuszczalnika.
P = CsolventPo
Ale prężność par rozpuszczalnika nie jest właściwością koligatywną. Jedynie zmiana prężności pary, która występuje po dodaniu substancji rozpuszczonej do rozpuszczalnika, może być uwzględniona wśród właściwości koligatywnych roztworu.
Ponieważ ciśnienie jest funkcją stanu, zmianę ciśnienia pary rozpuszczalnika, która występuje po dodaniu substancji rozpuszczonej do rozpuszczalnika, można zdefiniować jako różnicę między ciśnieniem pary czystego rozpuszczalnika a prężnością par rozpuszczalnika ucieczka od rozwiązania.
P = Po – P
Podstawienie prawa Raoulta do tego równania daje następujący wynik.
P = Po – Csolvent Po = (1 – Csolvent) Po
To równanie można uprościć, pamiętając o związku między ułamkiem molowym substancji rozpuszczonej a ułamkiem molowym rozpuszczalnika.
Csolute + Csolvent = 1
Podstawiając to związek w równaniu, które definiuje Pdaje inną formę prawa Raoulta.
P = CsolutePo
To równanie przypomina nam, że zmiana prężności pary rozpuszczalnika, która występuje po dodaniu substancji rozpuszczonej do rozpuszczalnika, jest proporcjonalna do ułamka molowego substancji rozpuszczonej. W miarę rozpuszczania substancji Moresolute w rozpuszczalniku prężność par rozpuszczalnika spada, a zmiana prężności par rozpuszczalnika wzrasta.
Ponieważ zmiany temperatury wrzenia rozpuszczalnika (TBP), które zachodzą po dodaniu substancji rozpuszczonej do rozpuszczalnika, wynikają ze zmian prężności par rozpuszczalnika, wielkość zmiany temperatury wrzenia jest również proporcjonalna do frakcji molowej substancji rozpuszczonej.
![]() TBP = kbsolute
TBP = kbsolute
W rozcieńczonych roztworach ułamek molowy substancji rozpuszczonej jest proporcjonalny do molalności roztworu, jak pokazano na rysunek poniżej.

Równanie opisujące wielkość elewacji temperatury wrzenia, która występuje po dodaniu substancji rozpuszczonej do rozpuszczalnika, jest często zapisywane w następujący sposób.
![]() TBP = kbm
TBP = kbm
Tutaj ![]() TBP to wysokość punktu wrzenia – zmiana temperatury wrzenia, która występuje, gdy substancja rozpuszczona rozpuszcza się w rozpuszczalniku
TBP to wysokość punktu wrzenia – zmiana temperatury wrzenia, która występuje, gdy substancja rozpuszczona rozpuszcza się w rozpuszczalniku ![]() , a kb jest stałą proporcjonalności znaną jako stała elewacji molowej temperatury wrzenia dla rozpuszczalnika.
, a kb jest stałą proporcjonalności znaną jako stała elewacji molowej temperatury wrzenia dla rozpuszczalnika.
Podobne równanie można zapisać, aby opisać, co dzieje się z temperaturą krzepnięcia (lub temperaturą topnienia) rozpuszczalnika po dodaniu substancji rozpuszczonej do rozpuszczalnika.
![]() TFP = -kfm
TFP = -kfm
W tym równaniu ![]() TFP to punkt zamarzania depresja
TFP to punkt zamarzania depresja ![]() zmiana temperatury krzepnięcia, która występuje, gdy substancja rozpuszcza się w rozpuszczalniku – a kf jest molową stałą obniżenia temperatury krzepnięcia dla rozpuszczalnika. W tym równaniu zastosowano znak ujemny, aby wskazać, że temperatura krzepnięcia rozpuszczalnika spada, gdy dodaje się substancję rozpuszczoną.
zmiana temperatury krzepnięcia, która występuje, gdy substancja rozpuszcza się w rozpuszczalniku – a kf jest molową stałą obniżenia temperatury krzepnięcia dla rozpuszczalnika. W tym równaniu zastosowano znak ujemny, aby wskazać, że temperatura krzepnięcia rozpuszczalnika spada, gdy dodaje się substancję rozpuszczoną.
Wartości kf i kbas oraz temperatury zamarzania i wrzenia dla szeregu czystych rozpuszczalników podano w poniższych tabelach.
Stałe depresji punktu zamarzania
Stałe podniesienia punktu wrzenia
Ćwicz problem 6:
Obliczyć masę cząsteczkową siarki, jeśli 35,5 gramów siarki rozpuści się w 100,0 gramach CS2, tworząc roztwór o temperaturze wrzenia 49,48oC.
Kliknij tutaj, aby sprawdzić odpowiedź na praktyczny problem 6
Kliknij tutaj, aby zobaczyć rozwiązanie praktycznego problemu 6
Zadanie praktyczne 7:
Określ masę cząsteczkową kwasu octowego, jeśli roztwór zawiera 30,0 gramów kwasu octowego na kilogram wody zamarza w temperaturze -0,93oC. Czy te wyniki zgadzają się z założeniem, że kwas octowy ma wzór CH3CO2H?
Kliknij tutaj, aby sprawdzić swoją odpowiedź na praktyczny problem 7
Kliknij tutaj, aby zobaczyć rozwiązanie praktycznego problemu 7
Co by się stało w obliczeniach w Praktyce? Problem 7 został powtórzony z silniejszym kwasem, takim jak kwas solny?
Zadanie praktyczne 8:
Wyjaśnij, dlaczego 0,100 m roztworu HCl rozpuszczonego w benzenie ma temperaturę krzepnięcia 0,512 ° C, podczas gdy 0,100 m roztwór HCl w wodzie ma temperaturę krzepnięcia 0,352 ° C.
Kliknij tutaj, aby sprawdzić swoją odpowiedź na problem praktyczny 8
W 1884 roku Jacobus Henricus van „t Hoff wprowadził inny termin do wyrażeń obniżenia temperatury zamarzania i podniesienia temperatury wrzenia, aby wyjaśnić koligatywne właściwości roztworów związków, które dysocjują, gdy rozpuszczają się w wodzie.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Podstawiając do tego równania wartość eksperymentalną obniżenia temperatury krzepnięcia roztworu 0,100 m HCl, daje wartość dla i członu 1,89. Gdyby HCl nie dysocjował w wodzie, wyniósłbym 1. Gdyby dysocjował całkowicie, wyniósłbym 2. Wartość eksperymentalna 1,89 sugeruje, że co najmniej 95% cząsteczek HCl dysocjuje w tym roztworze.
Praktyka Problem 9:
Wyjaśnij, dlaczego 0,60 grama kwasu octowego rozpuszcza się w 200 gramach benzenu, tworząc roztwór, który obniża temperaturę zamarzania benzenu do 5,40 ° C.
Kliknij tutaj, aby sprawdzić odpowiedź Ćwiczenie nr 9
![]()
Ciśnienie osmotyczne
W 1784 roku francuski fizyk i duchowny Jean AntoineNollet odkrył, że pęcherz świni wypełniony stężonym roztworem alkoholu w wodzie rozszerzył się po zanurzeniu w wodzie. Pęcherz działał jak półprzepuszczalna membrana, która pozwalała cząsteczkom wody dostać się do roztworu, ale powstrzymywała cząsteczki alkoholu przed przemieszczaniem się w przeciwnym kierunku. Przemieszczanie się jednego składnika roztworu przez membranę w celu rozcieńczenia roztworu nazywa się osmozą, a wytwarzane przez nią ciśnienie nazywa się ciśnieniem osmotycznym ().
Ciśnienie osmotyczne można zademonstrować za pomocą aparatu pokazanego na poniższym rysunku. W poprzek otwartego końca rurki z ostu jest zawiązana półprzepuszczalna membrana. Rurkę następnie częściowo napełnia się roztworem cukru lub alkoholu w wodzie i zanurza w górnej części wody. Woda będzie wpływać do rury, dopóki ciśnienie w słupie wody spowodowane siłą grawitacji zrównoważy ciśnienie teosmotyczne przepychające wodę przez membranę.

Woda przepływa membrana półprzepuszczalna do rozcieńczania roztworu alkoholu do momentu, gdy siła grawitacji działająca na kolumnę tego roztworu zrównoważy ciśnienie osmotyczne przepychające wodę przez membranę.
W tym samym roku, w którym Raoult odkrył zależność między prężnością pary roztworu a prężnością pary rozpuszczalnika czystego, Jacobus Henricus van „t Hoff odkrył, że ciśnienie osmotyczne rozcieńczonego roztworu () było zgodne z równaniem analogicznym do równania gazu doskonałego.
| |
= | nRT | ||
| V |
To równanie sugeruje, że ciśnienie osmotyczne jest innym przykładem właściwości koligacyjnej, ponieważ ciśnienie zależy od stosunku liczby cząstek substancji rozpuszczonej do objętości roztworu ![]() n / V
n / V ![]() , a nie od tożsamości cząstek rozpuszczonych. przypomina nam również o wielkości ciśnienia osmotycznego.Według tego równania a 1,00 Ms olution ma ciśnienie osmotyczne 22,4 atm przy 0oC.
, a nie od tożsamości cząstek rozpuszczonych. przypomina nam również o wielkości ciśnienia osmotycznego.Według tego równania a 1,00 Ms olution ma ciśnienie osmotyczne 22,4 atm przy 0oC.

Oznacza to, że roztwór 1,00 M powinien wytrzymać słup wody o wysokości 670 cali lub prawie 56 stóp !
Biolodzy i biochemicy często korzystają z ciśnienia osmotycznego, gdy izolują składniki komórki. Gdy komórka jest dodawana do roztworu wodnego, który zawiera znacznie większe stężenie jonów niż ciecz w komórce, woda opuszcza komórkę, przepływając przez błonę komórkową, aż komórka skurczy się tak bardzo, że membrana pęknie. Alternatywnie, gdy komórka jest umieszczana w roztworze o znacznie mniejszej sile jonowej, woda wlewa się do komórki, a komórka rozszerza się, aż pęknie błona komórkowa.
![]()
