Colligatieve eigenschappen
Dampdruk-onderdrukking
Fysische eigenschappen kunnen worden onderverdeeld in twee categorieën. Uitgebreide eigenschappen (zoals massa en volume) zijn afhankelijk van de grootte van het monster. Intensieve eigenschappen (zoals dichtheid en concentratie) zijn karakteristieke eigenschappen van de stof; ze zijn niet afhankelijk van de grootte van het onderzochte monster. Deze sectie introduceert een derde categorie die een subset is van de intensieve eigenschappen van een systeem. Deze derde categorie, bekend als colligatieve eigenschappen, kan alleen worden toegepast op oplossingen. Per definitie is een van de eigenschappen van een oplossing een colligatieve eigenschap als het alleen afhangt van de verhouding tussen het aantal deeltjes opgeloste stof en oplosmiddel in de oplossing, niet de identiteit van de opgeloste stof.
Zeer weinig van de fysische eigenschappen van een oplossing zijn colligatieve eigenschappen. Laten we als voorbeeld van deze beperkte reeks fysieke eigenschappen eens kijken wat er gebeurt met de dampdruk van het oplosmiddel als we een opgeloste stof toevoegen om een oplossing te vormen. We zullen Po definiëren als de dampdruk van de zuivere vloeistof ![]() het oplosmiddel
het oplosmiddel ![]() en P als de dampdruk van het oplosmiddel nadat een opgeloste stof is toegevoegd.
en P als de dampdruk van het oplosmiddel nadat een opgeloste stof is toegevoegd.
Po = dampdruk van de zuivere vloeistof, of oplosmiddel
P = dampdruk van het oplosmiddel in oplossing
Als de temperatuur van een vloeistof onder het kookpunt is punt, kunnen we aannemen dat de enige moleculen die uit de vloeistof kunnen ontsnappen om een gas te vormen, de moleculen zijn die dichtbij het oppervlak van de vloeistof liggen.
Wanneer een opgeloste stof aan het oplosmiddel wordt toegevoegd, nemen sommige van de opgeloste moleculen de ruimte in de buurt van het vloeistofoppervlak in, zoals weergegeven in de onderstaande afbeelding. Wanneer een opgeloste stof wordt opgelost in een oplosmiddel, neemt het aantal oplosmiddelmoleculen nabij het oppervlak af en neemt de dampspanning van het oplosmiddel af.

Dit heeft geen invloed op de snelheid waarmee oplosmiddelmoleculen in de gasfase condenseren om een vloeistof te vormen. Maar het vermindert de snelheid waarmee de oplosmiddelmoleculen in de vloeistof in de gasfase kunnen ontsnappen. Als resultaat moet de dampdruk van het oplosmiddel dat uit een oplossing ontsnapt kleiner zijn dan de dampdruk van het zuivere oplosmiddel.
| P | < | Po | ||
| dampspanning van de oplosmiddel boven een oplossing |
dampspanning van het zuivere oplosmiddel |
Tussen 1887 en 1888 toonde Francois-Marie Raoult dat de dampdruk van een oplossing gelijk aan de molfractie van het oplosmiddel maal de dampspanning van de zuivere vloeistof.
| P | = | Csolvent Po | ||||
| dampspanning van het oplosmiddel boven een oplossing |
dampspanning van het pure oplosmiddel |
Deze vergelijking, die bekend staat als de wet van Raoult, is gemakkelijk te begrijpen. Als het oplosmiddel zuiver is en de molefractie van het oplosmiddel gelijk is aan 1, is P gelijk aan Po. Naarmate de molfractie van het oplosmiddel kleiner wordt , wordt de dampdruk van het oplosmiddel dat uit de oplossing ontsnapt ook kleiner.
Laten we voorlopig aannemen dat het oplosmiddel de enige component van de oplossing is die voldoende vluchtig is om een meetbare dampspanning te hebben. Als dit waar is, zal de dampdruk van de oplossing gelijk zijn aan de dampspanning van het oplosmiddel dat uit de oplossing ontsnapt. De wet van Raoult suggereert dat het verschil tussen de dampspanning van het zuivere oplosmiddel en de oplossing toeneemt naarmate de molfractie van het oplosmiddel afneemt.
De verandering in de dampspanning die optreedt wanneer een stof aan een oplosmiddel wordt toegevoegd, is daarom een colligatieve eigenschap. als het afhangt van de molfractie van de opgeloste stof, dan moet het afhangen van de verhouding van het aantal deeltjes opgeloste stof tot het oplosmiddel in de oplossing, maar niet van de identiteit van de opgeloste stof.
![]()
Kookpuntverhoging en vriespuntverlaging
Onderstaande figuur toont de gevolgen van het feit dat opgeloste stoffen de dampspanning van een oplosmiddel verlagen. lijn die punten B en C in dit fasediagram verbindt, bevat de combinaties van temperatuur en druk waarbij het zuivere oplosmiddel en zijn damp in evenwicht zijn. Elk punt op deze lijn beschrijft daarom de dampspanning van het zuivere oplosmiddel bij die temperatuur. De stippellijn in deze figuur beschrijft de eigenschappen. e van een oplossing die wordt verkregen door een opgeloste stof in het oplosmiddel op te lossen.Bij elke gegeven temperatuur is de dampdruk van het oplosmiddel dat uit de oplossing ontsnapt kleiner dan de dampdruk van het zuivere oplosmiddel. De stippellijn ligt daarom onder de doorgetrokken lijn.
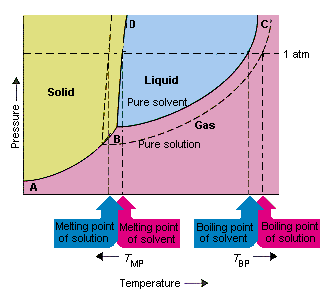
De afname van de dampdruk van het oplosmiddel die optreedt wanneer een opgeloste stof aan het oplosmiddel wordt toegevoegd, veroorzaakt een verhoging van het kookpunt en een verlaging van het smeltpunt van de oplossing.
Volgens deze figuur kan de oplossing “niet koken bij dezelfde temperatuur als het zuivere oplosmiddel. Als de dampdruk van het oplosmiddel dat uit de oplossing ontsnapt is kleiner dan de dampdruk van het zuivere oplosmiddel bij een bepaalde temperatuur, de oplossing moet worden verwarmd tot een hogere temperatuur voordat het kookt. de verlaging van de dampdruk van het oplosmiddel dat optreedt wanneer het wordt gebruikt om een oplossing te vormen verhoogt het kookpunt van de vloeistof.
Toen fasediagrammen werden geïntroduceerd, werd het tripelpunt gedefinieerd als de enige combinatie van temperatuur en druk waarbij gas, vloeistof en vaste stof tegelijkertijd kunnen bestaan. De bovenstaande afbeelding toont dat het tripelpunt van de oplossing optreedt bij een lagere temperatuur dan het tripelpunt van het zuivere oplosmiddel. Op zichzelf is de verandering in het tripelpunt niet belangrijk. Maar het resulteert in een verandering in de temperatuur waarbij de oplossing bevriest of smelt. waarom, we moeten er zorgzaam uitzien volledig op de lijn die de vaste en vloeibare gebieden in het faseschema scheidt. Deze lijn is bijna verticaal omdat het smeltpunt van een stof niet erg gevoelig is voor druk.
Het toevoegen van een opgeloste stof aan een oplosmiddel verandert niets aan de manier waarop het smeltpunt afhangt van de druk. De lijn die de vaste en vloeibare delen van de oplossing scheidt, loopt daarom parallel aan de lijn die dezelfde functie heeft voor het zuivere oplosmiddel Deze lijn moet echter door het tripelpunt gaan voor de oplossing. De afname van het tripelpunt die optreedt wanneer een stof wordt opgelost in een oplosmiddel, verlaagt daarom het smeltpunt van de oplossing.
Bovenstaande figuur laat zien hoe de verandering in dampspanning die optreedt wanneer een opgeloste stof in een oplosmiddel oplost, leidt tot veranderingen in het smeltpunt en het kookpunt van het oplosmiddel, omdat de verandering in dampspanning een colligatieve eigenschap is, die alleen afhangt van het relatieve aantal opgeloste stof en oplosmiddeldeeltjes zijn de veranderingen in het kookpunt en het smeltpunt van het oplosmiddel ook colligatieve eigenschappen.
![]()
ColligativeProperties-berekeningen
De beste manier om demonen te bestrijden Het belang van collectieve eigendommen is het onderzoeken van de gevolgen van de wet van Raoult. Raoult ontdekte dat de dampdruk van het oplosmiddel dat uit een oplossing ontsnapt evenredig is met de molfractie van het oplosmiddel.
P = CsolventPo
Maar de dampspanning van een oplosmiddel is geen colligatieve eigenschap. Alleen de verandering in de dampspanning die optreedt wanneer een opgeloste stof aan het oplosmiddel wordt toegevoegd, kan worden meegerekend bij de colligatieve eigenschappen van een oplossing.
Omdat druk een toestandsfunctie is, kan de verandering in de dampdruk van het oplosmiddel die optreedt wanneer een opgeloste stof aan het oplosmiddel wordt toegevoegd, worden gedefinieerd als het verschil tussen de dampdruk van het zuivere oplosmiddel en de dampdruk van het oplosmiddel. ontsnappen uit de oplossing.
P = Po – P
Het vervangen van de wet van Raoult in deze vergelijking geeft het volgende resultaat.
P = Po – Csolvent Po = (1 – Csolvent) Po
Deze vergelijking kan worden vereenvoudigd door de relatie tussen de molfractie van de opgeloste stof en de molefractie van het oplosmiddel te onthouden.
Csolute + Csolvent = 1
Dit substitueren relatie in de vergelijking die Pgives een andere vorm van de wet van Raoult definieert.
P = CsolutePo
Deze vergelijking herinnert ons eraan dat de verandering in de dampspanning van het oplosmiddel die optreedt wanneer een opgeloste stof aan het oplosmiddel wordt toegevoegd, evenredig is met de molfractie van de opgeloste stof. Naarmate meer opgeloste stof wordt opgelost in het oplosmiddel, neemt de dampspanning van het oplosmiddel af en neemt de verandering in de dampspanning van het oplosmiddel toe.
Omdat veranderingen in het kookpunt van het oplosmiddel (TBP) die optreden wanneer een opgeloste stof wordt toegevoegd aan een oplosmiddel het gevolg zijn van veranderingen in de dampspanning van het oplosmiddel, is de grootte van de verandering in het kookpunt ook evenredig tot de molefractie van de opgeloste stof.
![]() TBP = kbsolute
TBP = kbsolute
In verdunde oplossingen is de molfractie van de opgeloste stof evenredig met de molaliteit van de oplossing, zoals weergegeven in onderstaande figuur.

De vergelijking die de grootte van de kookpuntverhoging beschrijft die optreedt wanneer een opgeloste stof wordt toegevoegd aan een oplosmiddel, wordt daarom vaak als volgt geschreven.
![]() TBP = kbm
TBP = kbm
Hier ![]() TBP is de kookpuntverhoging – de verandering in het kookpunt die optreedt wanneer een opgeloste stof oplost in het oplosmiddel
TBP is de kookpuntverhoging – de verandering in het kookpunt die optreedt wanneer een opgeloste stof oplost in het oplosmiddel ![]() en kb is een evenredigheidsconstante die bekend staat als de molale kookpuntstijgingsconstante voor het oplosmiddel.
en kb is een evenredigheidsconstante die bekend staat als de molale kookpuntstijgingsconstante voor het oplosmiddel.
Een soortgelijke vergelijking kan worden geschreven om te beschrijven wat er gebeurt met het vriespunt (of smeltpunt) van een oplosmiddel wanneer een opgeloste stof aan het oplosmiddel wordt toegevoegd.
![]() TFP = -kfm
TFP = -kfm
In deze vergelijking is ![]() TFP het vriespunt depressie
TFP het vriespunt depressie ![]() de verandering in het vriespunt die optreedt wanneer de opgeloste stof oplost in het oplosmiddel – en kf is de molale vriespuntverlagingsconstante voor het oplosmiddel. In deze vergelijking wordt een minteken gebruikt om aan te geven dat het vriespunt van het oplosmiddel afneemt wanneer een opgeloste stof wordt toegevoegd.
de verandering in het vriespunt die optreedt wanneer de opgeloste stof oplost in het oplosmiddel – en kf is de molale vriespuntverlagingsconstante voor het oplosmiddel. In deze vergelijking wordt een minteken gebruikt om aan te geven dat het vriespunt van het oplosmiddel afneemt wanneer een opgeloste stof wordt toegevoegd.
Waarden van kf en kbas evenals de vriespunten en kookpunten voor een aantal zuivere oplosmiddelen worden in de onderstaande tabellen gegeven.
Vriespuntdepressieconstanten
Kookpunthoogteconstanten
Oefenopgave 6:
Bereken het molecuulgewicht van zwavel als 35,5 gram zwavel oplost in 100,0 gram CS2 om een oplossing te verkrijgen met een kookpunt van 49,48 oC.
Klik hier om je antwoord op oefenopgave 6 te bekijken
Klik hier om een oplossing voor oefenopgave 6 te zien
Oefenopgave 7:
Bepaal het molecuulgewicht van azijnzuur als een oplossing 30,0 gram azijnzuur per kilogram water bevriest bij -0,93oC. Zijn deze resultaten het eens met de veronderstelling dat azijnzuur de formule CH3CO2H heeft?
Klik hier om je antwoord op oefenopgave 7 te bekijken
Klik hier om een oplossing te zien voor oefenprobleem 7
Wat zou er gebeuren in de berekening in Praktijkprobleem 7 werd herhaald met een sterker zuur, zoals zoutzuur?
Oefenopgave 8:
Leg uit waarom een 0,100 m oplossing van HCl opgelost in benzeen een vriespuntverlaging heeft van 0,512oC, terwijl een 0,100 m oplossing van HCl in water een vriespuntverlaging heeft van 0,352oC.
Klik hier om je antwoord op oefenopgave 8 te bekijken.
In 1884 schreef Jacobus Henricus van “t Hoff introduceerde een andere term in de uitdrukkingen voor vriespuntverlaging en kookpuntverhoging om de colligatieve eigenschappen te verklaren van oplossingen van verbindingen die dissociëren wanneer ze oplossen in water.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Het substitueren van de experimentele waarde voor de vriespuntverlaging van een 0,100 m HCl-oplossing in deze vergelijking geeft een waarde voor de i-term van 1,89. Als HCl niet dissocieerde in water, zou i 1 zijn. Als het volledig dissocieert, zou ik 2 zijn. De experimentele waarde van 1,89 suggereert dat ten minste 95% van de HCl-moleculen dissociëren in deze oplossing.
Praktijk Opgave 9:
Leg uit waarom 0,60 gram azijnzuur oplost in 200 gram benzeen om een oplossing te vormen die het vriespunt van benzeen verlaagt tot 5,40 oC.
Klik hier om je antwoord op Oefenopgave 9
![]()
Osmotische druk
In 1784 ontdekte de Franse natuurkundige en predikant Jean AntoineNollet dat de blaas van een varken gevuld met een geconcentreerde oplossing van alcohol in water uitzet wanneer deze in water wordt ondergedompeld. De blaas fungeerde als een semi-permeabel membraan, waardoor watermoleculen de oplossing konden binnendringen, maar alcoholmoleculen niet in de andere richting konden bewegen. Beweging van één component van een oplossing door een membraan om de oplossing te verdunnen wordt osmose genoemd, en de geproduceerde druk wordt de osmotische druk () genoemd.
Osmotische druk kan worden aangetoond met het apparaat in de onderstaande afbeelding. Een semi-permeabel membraan wordt over het open uiteinde van een distelbuis gebonden. De buis wordt dan gedeeltelijk gevuld met een oplossing van suiker of alcohol in water en ondergedompeld in een bakje water. Water zal in de buis stromen totdat de druk op de waterkolom als gevolg van de zwaartekracht de theosmotische druk in evenwicht brengt die water door het membraan drijft.

Water stroomt door het semipermeabele membraan om de alcoholoplossing te verdunnen totdat de zwaartekracht die op de kolom van deze oplossing naar beneden trekt de osmotische druk in evenwicht brengt die het water door het membraan duwt.
In hetzelfde jaar dat Raoult het verband ontdekte tussen de dampspanning van een oplossing en de dampspanning van een zuiver oplosmiddel, Jacobus Henricus van “t Hoff ontdekte dat de osmotische druk van een verdunde oplossing () voldeed aan een vergelijking analoog aan de ideale gasvergelijking.
| |
= | nRT | ||
| V |
Deze vergelijking suggereert dat osmotische druk een ander voorbeeld is van een colligatieve eigenschap, omdat dit druk hangt af van de verhouding tussen het aantal opgeloste deeltjes en het volume van de oplossing ![]() n / V
n / V ![]() niet de identiteit van de opgeloste deeltjes. Het herinnert ons ook aan de grootte van osmotische druk Volgens deze vergelijking is een 1,00 M s olutionheeft een osmotische druk van 22,4 atm bij 0oC.
niet de identiteit van de opgeloste deeltjes. Het herinnert ons ook aan de grootte van osmotische druk Volgens deze vergelijking is een 1,00 M s olutionheeft een osmotische druk van 22,4 atm bij 0oC.

Dit betekent dat een oplossing van 1,00 M in staat moet zijn om een kolom met water van 170 inch of bijna 56 voet hoog te ondersteunen !
Biologen en biochemici maken vaak gebruik van osmotische druk wanneer ze de componenten van een cel isoleren. Wanneer een cel wordt toegevoegd aan een waterige oplossing die een veel hogere ionenconcentratie bevat dan de vloeistof in de cel, verlaat het water de cel door door het celmembraan te stromen totdat de cel zo sterk krimpt dat het membraan breekt. Als alternatief, wanneer een cel in een oplossing wordt geplaatst die een veel kleinere ionsterkte heeft, stroomt er water in de cel en zet de cel zich uit tot het celmembraan barst.
![]()
