ColligativeProperties
Vapor PressureDepression
As propriedades físicas podem ser divididas em duas categorias. Propriedades extensas (como massa e volume) dependem do tamanho da amostra. Propriedades intensivas (como densidade e concentração) são propriedades características da substância e não dependem do tamanho da amostra em estudo. Esta seção introduz uma terceira categoria que é um subconjunto das propriedades intensivas de um sistema. Esta terceira categoria, conhecida como propriedades coligativas, só pode ser aplicada a soluções. Por definição, uma das propriedades de uma solução é uma propriedade coligativa se depender apenas da proporção do número de partículas de soluto e solvente na solução, não da identidade do soluto.
Muito poucas das propriedades físicas de uma solução são propriedades coletivas. Como um exemplo desse conjunto limitado de propriedades físicas, vamos considerar o que acontece com a pressão de vapor do solvente quando adicionamos um soluto para formar uma solução. Definiremos Po como a pressão de vapor do líquido puro ![]() o solvente
o solvente ![]() e P como a pressão de vapor do solvente após a adição de um soluto.
e P como a pressão de vapor do solvente após a adição de um soluto.
Po = pressão de vapor do líquido puro, ou solvente
P = pressão de vapor do solvente em uma solução
Quando a temperatura de um líquido está abaixo de sua ebulição Nesse ponto, podemos supor que as únicas moléculas que podem escapar do líquido para formar um gás são aquelas que se encontram perto da superfície do líquido.
Quando um soluto é adicionado ao solvente, algumas das moléculas de soluto ocupam o espaço próximo à superfície do líquido, conforme mostrado na figura abaixo. Quando um soluto é dissolvido em um solvente, o número de moléculas de solvente próximas à superfície diminui e a pressão de vapor do solvente diminui.

Isso não tem efeito na taxa na qual as moléculas de solvente na fase gasosa se condensam para formar um líquido. Mas diminui a taxa em que as moléculas do solvente no líquido podem escapar para a fase gasosa. Como resultado, a pressão de vapor do solventescaping de uma solução deve ser menor do que a pressão de vapor do solvente puro.
| P | < | Po | ||
| pressão de vapor do solvente acima de uma solução |
pressão de vapor do solvente puro |
Entre 1887 e 1888, François-Marie Raoult mostrou que a pressão de vapor de uma solução é igual à fração molar do solvente vezes a pressão de vapor do líquido puro.
| P | = | Csolvent Po | ||||
| pressão de vapor do solvente acima de uma solução |
pressão de vapor do solvente puro |
Esta equação, que é conhecida como lei de Raoult, é fácil de entender. Quando o solvente é puro e a molefreção do solvente é igual a 1, P é igual a Po. À medida que a fração molar do solvente se torna menor , a pressão de vapor do solvente que escapa da solução também se torna menor.
Vamos supor, por enquanto, que o solvente seja o único componente da solução que é volátil o suficiente para ter uma pressão de vapor mensurável. Se isso for verdade, a pressão de vapor da solução será igual à pressão de vapor do solventescaping da solução. A lei de Raoult sugere que a diferença entre a pressão de vapor do solvente puro e a solução aumenta conforme a fração molar do solvente diminui.
A mudança na pressão de vapor que ocorre quando um soluto é adicionado a um solvente é portanto, uma propriedade coligativa. Se depender da fração molar do soluto, deve depender da proporção do número de partículas do soluto para o solvente na solução, mas não da identidade do soluto.
![]()
Ponto de ebuliçãoElevação e Depressão do ponto de congelamento
A figura abaixo mostra as consequências do fato de que os solutos reduzem a pressão de vapor de um solvente. os pontos de conexão de linha B e C neste diagrama de fase contêm as combinações de temperatura e pressão em que o solvente puro e seu vapor estão em equilíbrio. Cada ponto nesta linha, portanto, descreve a pressão de vapor do puro solvente a essa temperatura. A linha pontilhada nesta figura descreve os properti s de uma solução obtida pela dissolução de um sólido no solvente.Em qualquer temperatura, a pressão de vapor do solvente que escapa da solução é menor que a pressão de vapor do solvente puro. A linha pontilhada, portanto, fica abaixo da linha sólida.
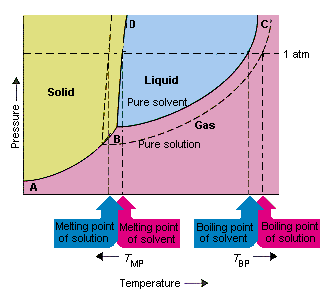
A diminuição em a pressão de vapor do solvente que ocorre quando um soluto é adicionado ao solvente causa um aumento no ponto de ebulição e diminuição no ponto de fusão da solução.
De acordo com esta figura, a solução não pode “ferver na mesma temperatura do solvente puro. Se a pressão de vapor de o solvente que escapa da solução é menor do que a pressão de vapor do solvente puro em qualquer temperatura, a solução deve ser aquecida a uma temperatura mais alta antes de ferver. A redução da pressão de vapor do solvente que ocorre quando ele é usado para formar uma solução, portanto aumenta o ponto de ebulição do líquido.
Quando os diagramas de fase foram introduzidos, o ponto triplo foi definido como a única combinação de temperatura e pressão na qual o gás, o líquido e o sólido podem existir ao mesmo tempo. A figura acima mostra que o ponto triplo da solução ocorre a uma temperatura mais baixa do que o ponto triplo do solvente puro. Por si só, a mudança no ponto triplo não é importante. Mas resulta em uma mudança na temperatura na qual a solução congela ou derrete. Para entender porque, temos que cuidar totalmente na linha que separa as regiões sólida e líquida no diagrama de fase. Essa linha é quase vertical porque o ponto de fusão de uma substância não é muito sensível à pressão.
Adicionar um soluto a um solvente não altera a maneira como o ponto de fusão depende da pressão. A linha que separa as regiões sólidas e líquidas da solução é, portanto, paralela à linha que tem a mesma função para o solvente puro . Esta linha deve passar pelo ponto triplo para a solução, no entanto. A diminuição do ponto triplo que ocorre quando um soluto é dissolvido em um solvente, portanto, diminui o ponto de fusão da solução.
A figura acima mostra como o mudança na pressão de vapor que ocorre quando um soluto se dissolve em um solvente leva a mudanças no ponto de fusão e no ponto de ebulição do solvente. Porque a mudança na pressão de vapor é uma propriedade coligativa, que depende apenas do número relativo de partículas de soluto e solvente , as mudanças no ponto de ebulição e no ponto de fusão do solvente também são propriedades coligativas.
![]()
Cálculos das propriedades coligativas
A melhor maneira de atingir os demônios trate a importância das propriedades coligativas é examinar as consequências da lei de Raoult. Raoult descobriu que a pressão de vapor do solvente que escapa de uma solução é proporcional à fração molar do solvente.
P = CsolventPo
Mas a pressão de vapor de um solvente não é uma propriedade coligativa. Apenas a mudança na pressão de vapor que ocorre quando um soluto é adicionado ao solvente pode ser incluída entre as propriedades coligativas de uma solução.
Como a pressão é uma função de estado, a mudança na pressão de vapor do solvente que ocorre quando um soluto é adicionado ao solvente pode ser definida como a diferença entre a pressão de vapor do solvente puro e a pressão de vapor do solvente escapando da solução.
P = Po – P
Substituindo a lei de Raoult nesta equação dá o seguinte resultado.
P = Po – Csolvente Po = (1 – Csolvente) Po
Esta equação pode ser simplificada lembrando a relação entre a fração molar do soluto e a molefreção do solvente.
Csoluto + Csolvente = 1
Substituindo isso relação na equação que define Pgives outra forma da lei de Raoult.
P = CsolutePo
Esta equação nos lembra que a mudança na pressão de vapor do solvente que ocorre quando um soluto é adicionado ao solvente é proporcional à fração molar do soluto. Conforme o moresolute é dissolvido no solvente, a pressão de vapor do solvente diminui e a alteração na pressão de vapor do solvente aumenta.
Como as mudanças no ponto de ebulição do solvente (TBP) que ocorrem quando um soluto é adicionado a um solvente resultam de mudanças na pressão de vapor do solvente, a magnitude da mudança no ponto de ebulição também é proporcional para a molefrização do soluto.
![]() TBP = kbsolute
TBP = kbsolute
Em soluções diluídas, a fração molar do soluto é proporcional à molalidade da solução, conforme mostrado em a figura abaixo.

A equação que descreve a magnitude da elevação do ponto de ebulição que ocorre quando um soluto é adicionado a um solvente é, portanto, frequentemente escrita como segue.
![]() TBP = kbm
TBP = kbm
Aqui, ![]() TBP é a elevação do ponto de ebulição – a mudança no ponto de ebulição que ocorre quando um soluto se dissolve no solvente
TBP é a elevação do ponto de ebulição – a mudança no ponto de ebulição que ocorre quando um soluto se dissolve no solvente ![]() e kb é uma constante de proporcionalidade conhecida como a constante de elevação do ponto de ebulição molal para o solvente.
e kb é uma constante de proporcionalidade conhecida como a constante de elevação do ponto de ebulição molal para o solvente.
Uma equação semelhante pode ser escrita para descrever o que acontece com o ponto de congelamento (ou ponto de fusão) de um solvente quando um soluto é adicionado ao solvente.
![]() TFP = -kfm
TFP = -kfm
Nesta equação, ![]() TFP é o ponto de congelamento depressão
TFP é o ponto de congelamento depressão ![]() a mudança no ponto de congelamento que ocorre quando o soluto se dissolve no solvente – e é a constante de depressão do ponto de congelamento molal para o solvente. Um sinal negativo é usado nesta equação para indicar que o ponto de congelamento do solvente diminui quando um soluto é adicionado.
a mudança no ponto de congelamento que ocorre quando o soluto se dissolve no solvente – e é a constante de depressão do ponto de congelamento molal para o solvente. Um sinal negativo é usado nesta equação para indicar que o ponto de congelamento do solvente diminui quando um soluto é adicionado.
Os valores de kf e kbas, bem como os pontos de congelamento e de ebulição para diversos solventes puros, são fornecidos nas tabelas abaixo.
Constantes de depressão de ponto de congelamento
Constantes de elevação de ponto de ebulição
Problema prático 6:
Calcule o peso molecular do enxofre se 35,5 gramas de enxofre se dissolverem em 100,0 gramas de CS2 para produzir uma solução com ponto de ebulição de 49,48oC.
Clique aqui para verificar sua resposta para o Problema Prático 6
Clique aqui para ver uma solução para o Problema Prático 6
Problema prático 7:
Determine o peso molecular do ácido acético se uma solução que contém 30,0 gramas de ácido acético por quilograma de água congela a -0,93oC. Esses resultados concordam com a suposição de que o ácido acético tem a fórmula CH3CO2H?
Clique aqui para verificar sua resposta para o Problema Prático 7
Clique aqui para ver uma solução para o Problema Prático 7
O que aconteceria no cálculo no Problema prático 7 fosse repetido com um ácido mais forte, como o ácido clorídrico?
Problema prático 8:
Explique por que uma solução de 0,100 m de HCl dissolvido em benzeno tem uma depressão de ponto de congelamento de 0,512oC, enquanto uma solução de 0,100 m de HCl em água tem uma depressão de ponto de congelamento de 0,352oC.
Clique aqui para verificar sua resposta ao Problema prático 8
Em 1884 Jacobus Henricus van “t Hoff introduziu outro término nas expressões de depressão do ponto de congelamento e elevação do ponto de ebulição para explicar as propriedades coligativas de soluções de compostos que se dissociam quando se dissolvem na água.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Substituir o valor experimental para o ponto de congelamento depressão de uma solução de HCl 0,100 m nesta equação dá um valor para o termo i de 1,89. Se o HCl não se dissociasse em água, i seria 1. Se ele se dissociar completamente, eu seria 2. O valor experimental de 1,89 sugere que pelo menos 95% das moléculas de HCl se dissociam nesta solução.
Prática Problema 9:
Explique por que 0,60 grama de ácido acético se dissolvem em 200 gramas de benzeno para formar uma solução que reduz o ponto de congelamento do benzeno para 5,40oC.
Clique aqui para verificar sua resposta para Problema prático 9
![]()
Pressão osmótica
Em 1784, o físico e clérigo francês Jean AntoineNollet descobriu que a bexiga de um porco cheia de uma solução concentrada de álcool em água se expandia quando era imersa na água. A bexiga agia como uma membrana semipermeável, que permitia que as moléculas de água entrassem na solução, mas impedia que as moléculas de álcool se movessem na outra direção. O movimento de um componente de uma solução através de uma membrana para diluir a solução é chamado de osmose, e a pressão que ela produz é chamada de pressão osmótica ().
A pressão osmótica pode ser demonstrada com o aparelho mostrado na figura abaixo. Uma membrana semipermeável é amarrada na extremidade aberta de um tubo de cardo. O tubo é então parcialmente preenchido com uma solução de açúcar ou álcool em água e imerso em um copo d’água. A água fluirá para o tubo até que a pressão na coluna de água, devido à força da gravidade, equilibre a pressão osmótica que conduz a água através da membrana.

A água flui através a membrana semipermeável para diluir a solução de álcool até que a força da gravidade puxando para baixo a coluna dessa solução equilibre a pressão osmótica empurrando a água através da membrana.
No mesmo ano em que Raoult descobriu a relação entre a pressão de vapor de uma solução e a pressão de vapor de um puro solvente, Jacobus Henricus van “t Hoff descobriu que a pressão osmótica de uma solução diluída () obedecia a uma equação análoga à equação do gás ideal.
| |
= | nRT | ||
| V |
Esta equação sugere que a pressão osmótica é outro exemplo de uma propriedade coligativa, porque isso a pressão depende da razão entre o número de partículas de soluto e o volume da solução ![]() n / V
n / V ![]() e não da identidade das partículas de soluto. também nos lembra a magnitude da pressão osmótica. De acordo com esta equação, a 1,00 M s olution tem uma pressão osmótica de 22,4 atm a 0oC.
e não da identidade das partículas de soluto. também nos lembra a magnitude da pressão osmótica. De acordo com esta equação, a 1,00 M s olution tem uma pressão osmótica de 22,4 atm a 0oC.

Isso significa que uma solução de 1,00 M deve ser capaz de suportar uma coluna de água de 670 polegadas ou quase 56 pés de altura !
Biólogos e bioquímicos costumam tirar proveito da pressão osmótica ao isolar os componentes de uma célula. Quando uma célula é adicionada a uma solução aquosa que contém uma concentração muito maior de íons do que o líquido dentro da célula, a água sai da célula fluindo através da membrana celular até que a célula encolha tanto que a membrana se rompe. Alternativamente, quando uma célula é colocada em uma solução que tem uma força iônica muito menor, a água flui para dentro da célula, e a célula se expande até que a membrana celular se rompe.
![]()
