ColligativeProperties
Depresiunea vaporilor
Proprietățile fizice pot fi împărțite în două categorii. Proprietățile extinse (cum ar fi masa și volumul) depind de mărimea eșantionului. Proprietățile intensive (cum ar fi densitatea și concentrarea) sunt proprietăți caracteristice ale substanței; nu depind de mărimea probei studiate. Această secțiune introduce o a treia categorie, care este un subset al proprietăților intensive ale unui sistem. Această a treia categorie, cunoscută sub numele de proprietăți coligative, poate fi aplicată numai soluțiilor. Prin definiție, una dintre proprietățile unei soluții este o proprietate coligativă dacă depinde doar de raportul numărului de particule de solut și solvent din soluție, nu de identitatea solutului.
Foarte puține dintre proprietățile fizice ale unei soluții sunt proprietăți coligative. Ca exemplu al acestui set limitat de proprietăți fizice, să luăm în considerare ce se întâmplă cu presiunea de vapori a solventului atunci când adăugăm un dizolvat pentru a forma o soluție. Vom defini Po ca presiunea de vapori a lichidului pur „> solventul ![]() și P ca presiune de vapori a solventului după adăugarea unui dizolvat.
și P ca presiune de vapori a solventului după adăugarea unui dizolvat.
Po = presiunea de vapori a lichidului pur sau solvent
P = presiunea de vapori a solventului în soluție
Când temperatura unui lichid este sub fierbere punct, putem presupune că singurele molecule care pot scăpa din lichid pentru a forma un gaz sunt cele care se află lângă suprafața lichidului.
Când se adaugă un solvent la solvent, unele dintre moleculele solutive ocupă spațiul de lângă suprafața lichidului, prezentat în figura de mai jos. Când un dizolvat este dizolvat într-un solvent, numărul de molecule de solvent în apropierea suprafeței scade, iar presiunea de vapori a solventului scade.

Acest lucru nu are niciun efect asupra vitezei cu care moleculele de solvent din faza gazoasă se condensează pentru a forma un lichid. Dar scade nivelul în care moleculele solventului din lichid pot scăpa în faza gazoasă. Ca urmare, presiunea de vapori a solventului care scapă dintr-o soluție ar trebui să fie mai mică decât presiunea de vapori a solventului pur.
| P | < | Po | ||
| presiunea de vapori a solvent deasupra unei soluții |
presiunea de vapori a solventului pur |
Între 1887 și 1888, Francois-Marie Raoult a arătat că presiunea de vapori a unei soluții este egală cu fracția molară a solventului de ori mai mare decât presiunea de vapori a lichidului pur.
| P | = | Csolvent Po | ||||
| presiunea vaporilor de solvent deasupra unei soluții |
presiunea de vapori a solventului pur |
Această ecuație, cunoscută sub numele de legea lui Raoult, este ușor de înțeles. Când solventul este pur și molefracția solventului este egală cu 1, P este egală cu Po. Pe măsură ce fracția molară a solventului devine mai mică , presiunea de vapori a solventului care scapă din soluție devine, de asemenea, mai mică.
Să presupunem, pentru moment, că solventul este singurul component al soluției care este suficient de volatil pentru a avea o presiune de vapori măsurabilă. Dacă acest lucru este adevărat, presiunea de vapori a soluției va fi egală cu presiunea de vapori a solventului care scapă din soluție. Legea lui Raoult sugerează că diferența dintre presiunea de vapori a solventului pur și soluție crește pe măsură ce fracția molară a solventului scade.
Modificarea presiunii de vapori care are loc atunci când se adaugă solut la un solvent este prin urmare, o proprietate coligativă. Dacă depinde de fracția molară a solutului, atunci trebuie să depindă de raportul numărului de particule de solut tosolvent din soluție, dar nu de identitatea solutului.
![]()
Punctul de fierbere: creșterea și depresiunea punctului de îngheț
Figura de mai jos arată consecințele faptului că soluțiile scad presiunea de vapori a unui solvent. conectarea punctelor B și C în această diagramă de fază conține combinațiile de temperatură și presiune la care solventul pur și vaporii săi sunt în echilibru. Fiecare punct de pe această linie descrie, prin urmare, presiunea de vapori a solventului pur la temperatura respectivă. Linia punctată din această figură esențiale ale unei soluții obținute prin dizolvarea solutului în solvent.La orice temperatură dată, presiunea de vapori a solventului care iese din soluție este mai mică decât presiunea de vapori a solventului pur. Prin urmare, linia punctată se află sub linia continuă.
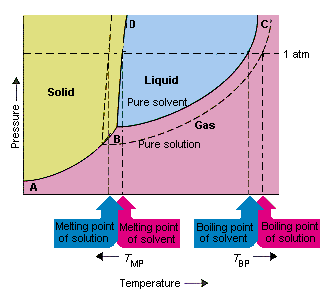
Scăderea presiunea de vapori a solventului care apare atunci când se adaugă un solvent la solvent determină o creștere a punctului de fierbere și scăderea punctului de topire a soluției.
Conform acestei figuri, soluția nu poate „fierbe la aceeași temperatură ca solvent pur. Dacă presiunea vaporilor de Solventul care scapă din soluție este mai mic decât presiunea de vapori a solventului pur la orice temperatură dată, soluția trebuie încălzită la o temperatură mai mare înainte de fierbere. Scăderea presiunii de vapori a solventului care apare atunci când este utilizat pentru a forma o soluție, prin urmare crește punctul de fierbere al lichidului.
Când au fost introduse diagramele de fază, punctul triplu a fost definit ca singura combinație de temperatură și presiune la care gazul, lichidul și solidul pot exista în același timp. Figura de mai sus arată că punctul triplu al soluției are loc la o temperatură mai scăzută decât punctul triplu al solventului pur. În sine, schimbarea punctului triplu nu este importantă. Dar are ca rezultat o modificare a temperaturii la care soluția îngheță sau se topește. Pentru a înțelege de ce, trebuie să ne uităm cu grijă complet pe linia care separă regiunile solide și lichide din faza diagramă. Această linie este aproape verticală, deoarece punctul de topire al unei substanțe nu este foarte sensibil la presiune.
Adăugarea unui dizolvat la un solvent nu schimbă modul în care punctul de topire depinde de presiune. Linia care separă regiunile solide și lichide ale soluției este, prin urmare, paralelă cu linia care are aceeași funcție pentru solventul pur Cu toate acestea, această linie trebuie să treacă prin punctul triplu al soluției. Scăderea punctului triplu care apare atunci când soluția este dizolvată într-un solvent scade, prin urmare, punctul de topire al soluției.
Figura de mai sus arată cum modificarea presiunii de vapori care se produce atunci când un dizolvat se dizolvă într-un solvent duce la modificări la punctul de topire și la punctul de fierbere al solventului. Deoarece modificarea presiunii de vapori este o proprietate coligativă, care depinde doar de numărul relativ de particule de dizolvat și solvent , modificările punctului de fierbere și al punctului de topire al solventului sunt, de asemenea, proprietăți coligative.
![]()
Calcule proprietăți coligative
Cel mai bun mod de a ajunge la demoni Verificați importanța proprietăților coligative este de a examina consecințele legii lui Raoult. Am constatat că presiunea de vapori a solventului care iese din soluție este proporțională cu fracția molară a solventului.
P = CsolventPo
Dar presiunea de vapori a unui solvent nu este o proprietate coligativă. Numai modificarea presiunii de vapori care apare atunci când se adaugă un solvent la solvent poate fi inclusă printre proprietățile coligative ale unei soluții.
Deoarece presiunea este o funcție de stare, schimbarea presiunii de vapori a solventului care are loc atunci când se adaugă un solvent la solvent poate fi definită ca diferența dintre presiunea de vapor a solventului pur și presiunea de vapori a solventului. evadând din soluție.
P = Po – P
Înlocuirea legii lui Raoult în această ecuație dă următorul rezultat.
P = Po – Csolvent Po = (1 – Csolvent) Po
Această ecuație poate fi simplificată prin amintirea relației dintre fracția molară a solutului și molefrația solventului.
Csolute + Csolvent = 1
Înlocuind acest lucru relația în ecuația care definește Pgives o altă formă a legii lui Raoult.
P = CsolutePo
Această ecuație ne amintește că schimbarea presiunii de vapori a solventului care are loc atunci când un solvent este adăugat la solvent este proporțională cu fracția molară a solutului. Pe măsură ce moresolutul se dizolvă în solvent, presiunea de vapori a solventului scade și modificarea presiunii de vapori a solventului crește.
Deoarece modificările punctului de fierbere al solventului (TBP) care apar atunci când un solvent este adăugat la un solvent rezultă din modificări ale presiunii de vapori a solventului, magnitudinea schimbării punctului de fierbere este, de asemenea, proporțională la molefrația solutului.
![]() TBP = kbsolute
TBP = kbsolute
În soluțiile diluate, fracția molară a solutului este proporțională cu molalitatea soluției, așa cum se arată în figura de mai jos.

Ecuația care descrie magnitudinea punctului de fierbere care apare atunci când se adaugă un solvent la un solvent este, prin urmare, adesea scrisă după cum urmează.
![]() TBP = kbm
TBP = kbm
Aici, ![]() TBPis elevația punctului de fierbere – modificarea punctului de fierbere care apare atunci când un dizolvat se dizolvă în solvent
TBPis elevația punctului de fierbere – modificarea punctului de fierbere care apare atunci când un dizolvat se dizolvă în solvent ![]() și kb este o constantă de proporționalitate cunoscută ca constantă de înălțime a punctului de fierbere molar pentru solvent.
și kb este o constantă de proporționalitate cunoscută ca constantă de înălțime a punctului de fierbere molar pentru solvent.
O ecuație similară poate fi scrisă pentru a descrie ce se întâmplă la punctul de îngheț (sau punctul de topire) al unui solvent atunci când un solvent este adăugat la solvent.
![]() TFP = -kfm
TFP = -kfm
În această ecuație, ![]() TFP este punctul de îngheț depresie
TFP este punctul de îngheț depresie ![]() modificarea punctului de îngheț care are loc atunci când dizolvatul se dizolvă în solvent – și kfis constanta de depresie a punctului de îngheț molar pentru solvent. Un semn negativ este utilizat în această ecuație pentru a indica faptul că punctul de îngheț al solventului scade atunci când se adaugă un dizolvat.
modificarea punctului de îngheț care are loc atunci când dizolvatul se dizolvă în solvent – și kfis constanta de depresie a punctului de îngheț molar pentru solvent. Un semn negativ este utilizat în această ecuație pentru a indica faptul că punctul de îngheț al solventului scade atunci când se adaugă un dizolvat.
Valorile kf și kbas, precum și punctele de îngheț și punctele de fierbere pentru un număr de solvenți pur sunt date în tabelele de mai jos.
Constantele de depresie ale punctului de îngheț
Constantele de ridicare ale punctului de fierbere
Problema de practică 6:
Calculați greutatea moleculară a sulfului dacă 35,5 grame de sulf se dizolvă în 100,0 grame de CS2 pentru a produce o soluție care are un punct de fierbere de 49,48oC.
Faceți clic aici pentru a verifica răspunsul la problema de practică 6
Faceți clic aici pentru a vedea o soluție la problema de practică 6
Problema de practică 7:
Determinați greutatea moleculară a acidului acetic dacă o soluție care conține 30,0 grame de acid acetic pe kilogramul de apă îngheață la -0,93oC. Aceste rezultate sunt de acord cu presupunerea că acidul acetic are formula CH3CO2H?
Faceți clic aici pentru a verifica răspunsul la Problema 7 de practică
Faceți clic aici pentru a vedea o soluție la Problema 7 de practică
Ce s-ar întâmpla în calculul din Problema practică 7 s-a repetat cu un acid mai puternic, cum ar fi acidul clorhidric?
Problema practică 8:
Explicați de ce o soluție de HCl de 0,100 m dizolvată în benzen are o depresiune a punctului de îngheț de 0,512oC, în timp ce o soluție de HCl de 0,100 m în apă are o depresiune a punctului de îngheț de 0,352oC.
Faceți clic aici pentru a verifica răspunsul la problema de practică 8
În 1884 Jacobus Henricus van „t Hoff a introdus un alt termen în expresia depresiunii punctului de îngheț și a punctului de fierbere pentru a explica proprietățile coligative ale soluțiilor de compuși care se disociază atunci când se dizolvă în apă.
![]() TFP = – kf (i) m
TFP = – kf (i) m
Înlocuind valoarea experimentală pentru depresia punctului de îngheț al unei soluții de HCl de 0,100 m în această ecuație, se dă o valoare pentru termenul i de 1,89. Dacă HCl nu s-ar disocia în apă, aș fi 1. Dacă se disociază complet, aș fi 2. Valoarea experimentală de 1,89 sugerează cel puțin 95% din moleculele de HCl disociază în această soluție.
Practică Problema 9:
Explicați de ce 0,60 grame de acid acetic se dizolvă în 200 de grame de benzen pentru a forma o soluție care scade punctul de înghețare a benzenului la 5,40oC.
Faceți clic aici pentru a verifica răspunsul la Problema practică 9
![]()
Presiunea osmotică
În 1784, fizicianul și duhovnicul francez Jean AntoineNollet a descoperit că vezica urinară a unui porc umplută cu o soluție concentrată de alcool în apă s-a extins când a fost scufundat în apă. Vezica a acționat ca o membrană semipermeabilă, care a permis moleculelor de apă să pătrundă în soluție, dar a împiedicat moleculele de alcool să se miște în cealaltă direcție. Mișcarea unei componente a unei soluții printr-o membrană pentru a dilua soluția se numește osmoză, iar presurethis produce se numește presiune osmotică ().
Presiunea osmotică poate fi demonstrată cu aparatul prezentat în figura de mai jos. O membrană semipermeabilă este legată de capătul deschis al unui tub de ciulin. Tubul este apoi parțial umplut cu o soluție de zahăr sau alcool în apă și scufundat într-un vas de apă. Apa va curge în tub până când presiunea pe coloana de apă datorită forței gravitaționale echilibrează presiunea teosmotică care conduce apa prin membrană.

Apa curge prin membrana semipermeabilă pentru a dilua soluția de alcool până când forța gravitațională care trage în jos pe coloana acestei soluții echilibrează presiunea osmotică împingând apa prin membrană.
În același an în care Raoult a descoperit relația dintre presiunea de vapori a unei soluții și presiunea de vapori a unui puresolvent, Jacobus Henricus van „t Hoff a constatat că presiunea osmotică a unei soluții diluate () a respectat o ecuație analogă ecuației gazului ideal.
| |
= | nRT | ||
| V |
Această ecuație sugerează că presiunea osmotică este un alt exemplu al unei proprietăți coligative, deoarece aceasta presiunea depinde de raportul dintre numărul de particule dizolvate și volumul soluției ![]() n / V
n / V ![]() nu de identitatea particulelor solut. ne amintește, de asemenea, de magnitudinea presiunii osmotice. Conform acestei ecuații, o 1,00 M s olution are o presiune osmotică de 22,4 atm la 0oC.
nu de identitatea particulelor solut. ne amintește, de asemenea, de magnitudinea presiunii osmotice. Conform acestei ecuații, o 1,00 M s olution are o presiune osmotică de 22,4 atm la 0oC.

Aceasta înseamnă că o soluție de 1,00 M ar trebui să poată susține o coloană de apă de 670 inci sau aproape 56 de picioare înălțime !
Biologii și biochimiștii profită adesea de presiunea osmotică atunci când izolează componentele unei celule. Când o celulă este adăugată la o soluție apoasă care conține o concentrație de ioni mult mai mare decât lichidul din celulă, apa lasă celula curgând prin membrana celulară până ce celula se micșorează atât de mult încât membrana se rupe. Alternativ, atunci când o celulă este plasată într-o soluție care are o forță ionică mult mai mică, apa se revarsă în celulă, iar celula se extinde până când membrana celulei izbucnește.
![]()
