Reversibel posterior leukoencefalopati syndrom (RPLS)
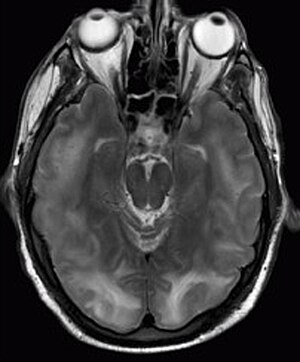
Posterior reversibel encefalopati syndrom synlig på magnetisk resonansavbildning som multipel kortiko -subkortikale områder av T2-vektet hyperintense (hvitt) signal som involverer occipitale og parietale lober bilateralt og pons.
Neurologi
Anfall, hodepine, synsforstyrrelser, endret mental tilstand, noen ganger svakhet i lemmer eller manglende evne til å snakke
Intrakraniell blødning
Posterior reversibel encefalopati syndrom (PRES), også kjent som reversibelt posterior leukoencefalopati syndrom (RPLS), er en sjelden tilstand der deler av hjernen påvirkes av hevelse, vanligvis som et resultat av en underliggende årsak. Noen med PRES kan oppleve hodepine, synsforandringer og anfall, og noen utvikler andre nevrologiske symptomer som forvirring eller svakhet i en eller flere lemmer. Navnet på tilstanden inkluderer ordet «posterior» fordi det overveiende men ikke utelukkende påvirker baksiden av hjernen (parietal og occipital lobes). Vanlige underliggende årsaker er alvorlig forhøyet blodtrykk, nyresvikt, alvorlige infeksjoner, visse medisiner, noen autoimmune sykdommer og svangerskapsforgiftning. Diagnosen stilles vanligvis ved hjerneskanning (MR) på hvilke områder av hevelse som kan identifiseres.
Behandlingen av PRES er støttende: fjerning av årsaken eller årsakene og behandling av noen av komplikasjonene, som f.eks. krampestillende midler mot anfall. PRES kan være komplisert av intrakraniell blødning, men dette er relativt sjeldent. De fleste mennesker blir friske, selv om noen kan oppleve noen gjenværende symptomer. PRES ble først beskrevet i 1996.
Tegn og symptomer
PRES har vanligvis et akutt utbrudd. De fleste med PRES opplever hodepine og kramper; mange opplever også visuelle endringer, forvirring og døsighet, svakhet i armen og / eller benet på den ene siden av kroppen (hemiplegi), vanskeligheter med å snakke, eller sjeldnere andre nevrologiske symptomer. De visuelle endringene i PRES kan omfatte hemianopsi (manglende evne til å se den venstre eller høyre delen av synsfeltet), sløret syn, mangel på visuell bevissthet på den ene siden, synshallusinasjoner og kortikal blindhet.
Anfall forekommer i omtrent to tredjedeler av tilfellene. Hos barn er dette fortsatt vanligst, 90%. Hvis kramper oppstår, kan de være fokuserte eller generaliserte. En liten andel utvikler status epilepticus, der anfall ikke kontrolleres med enkle tiltak.
Årsaker
Årsaker som kan bidra til utvikling av PRES er: immunsuppresjon (spesielt for organtransplantasjon, f.eks. med takrolimus), alvorlig infeksjon og / eller sepsis, cellegift, autoimmun sykdom og svangerskapsforgiftning. Det er ofte høyt blodtrykk. Tilsvarende har de fleste med PRES nedsatt nyrefunksjon, og 21% får regelmessig hemodialyse. I PRES relatert til medisiner kan det være et intervall på uker til måneder mellom behandlingsstart og utvikling av PRES. Etter en hematopoietisk stamcelletransplantasjon (benmargstransplantasjon) er risikoen for PRES ca. 8%, mens risikoen er lavere (0,4-6%) etter en solid organtransplantasjon.
Følgende autoimmune tilstander har vært funnet å være assosiert med PRES: trombotisk trombocytopenisk purpura (TTP), primær skleroserende kolangitt (PSC), revmatoid artritt (RA), Sjögrens syndrom, polyarteritt nodosa (PAN), systemisk sklerose, systemisk lupus erythematosus (SLE), granulomatose med polyangiitt (SLE) GPA), Crohns sykdom og neuromyelitt optica (NMO), samt hemolytisk-uremisk syndrom (HUS). En rekke andre foreninger er også rapportert, inkludert noen andre grupper med medisiner, blodtransfusjon, forhøyede kalsiumnivåer, redusert magnesiumnivåer, postpartum cerebral angiopati og misbruk av stoffer (kokain og amfetamin).
Det har blitt antydet at PRES er identisk eller nært beslektet med hypertensiv encefalopati, tilstedeværelsen av nevrologiske symptomer hos de med en hypertensiv nødsituasjon.
Mekanisme
Selv om den presise mekanismen er PRES ikke er fullstendig forstått, anses den å være relatert til et problem med hjernens blodkar. Det er flere teorier om hvorfor disse blodkarene kan bli uhensiktsmessig gjennomtrengelige og la det omkringliggende hjernevevet bli hovent. Den «vasogene» teorien antar at ekstremt høyt blodtrykk overvinner den normale evnen til blodkar i hjernen til å opprettholde en normal cerebral blodstrøm. Det overdrevne trykket skader endotelaget og blod-hjerne-barrieren, noe som fører til hevelse (ødem).Dette påvirker overveiende de «bakre» delene av hjernen som er mer utsatt. Den «vasogene» teorien ser ut til å forklare nesten 50% av tilfellene av PRES der det hadde vært sterkt forhøyet blodtrykk. Det kalles også «gjennombrudd» -teorien, eller «hyperperfusjonsteorien». Denne teorien forklarer ikke ødem i mange andre tilfeller der blodtrykket har vært normalt eller til og med lavt; faktisk ødem har en tendens til å være mer alvorlig hos de uten unormalt forhøyet blodtrykk.
I PRES sekundært til andre årsaker har blodkarskaden blitt tilskrevet andre mekanismer. Den «cytotoksiske» teorien antyder at det er direkte celleskade av giftstoffer (vanligvis medisiner) som utfeller ødem. Den «immunogene» teorien antyder en rolle for immunforsvaret (spesielt T-celler). Noen anser de cellegiftige og immunogene teoriene sammen som en enkelt «giftig» teori. Det ser ut til å være en rolle av cytokiner i å forårsake endotel dysfunksjon.
Til slutt, ifølge «neuropeptid / cerebral vasoconstriction» teori, utløser noen spesifikke stoffer (endotelin 1, tromboxan A2) krampe i blodårene med resulterende skade på karveggen og ødem. Sistnevnte hypotese støttes av hyppig funn av diffuse blodkar spasmer (vasokonstriksjon) hos mange mennesker med PRES, og bevisene for nedsatt perfusjon, selv om spasmen også kan være en konsekvens av blodkarskaden i stedet for årsaken. Noen inkluderer derfor vasospasmen i den «giftige» teorien. Det anses å være sannsynlig at disse flere mekanismene potensielt spiller en rolle i utviklingen av PRES.
Diagnose
Det er ingen formelle diagnostiske kriterier for PRES, men det er blitt foreslått at PRES kan diagnostiseres hvis noen har utviklet akutte nevrologiske symptomer (anfall, endret mental tilstand, hodepine, synsforstyrrelser) sammen med en eller flere kjente risikofaktorer, typisk utseende på hjernebehandling (eller normal bildebehandling), og ingen annen alternativ diagnose. Noen mener at avvikene må vises for å være reversible. Hvis lumbal punktering utføres, kan dette vise økte proteinnivåer, men ingen hvite blodlegemer. Datatomografisk skanning kan utføres i første omgang; dette kan vise hvite materieområder med lav tetthet i de bakre lappene.
Diagnosen stilles vanligvis med magnetisk resonansavbildning av hjernen. Funnene som er mest karakteristiske for PRES er symmetriske hyperintensiteter på T2-veid bildebehandling i parietal og occipital lobes; dette mønsteret er tilstede i mer enn halvparten av alle tilfeller. FLAIR-sekvenser kan være bedre til å vise disse avvikene. Noen spesifikke andre sjeldne mønstre er beskrevet: det overlegne frontal sulcus (SFS) vannskillemønsteret, et vannskillemønster som involverer hele halvkulen (holohemisfærisk), og et sentralt mønster med vasogent ødem i den dype hvite substansen, basalganglier, thalami, hjernestamme og pons. Disse forskjellige mønstrene korrelerer vanligvis ikke med symptomene eller alvorlighetsgraden, selv om alvorlig ødem kan tyde på en dårligere prognose. Hvis utseendet ikke er typisk, må andre årsaker til symptomene og bildeavvikene vurderes før PRES kan diagnostiseres avgjørende. I mange tilfeller er det tegn på innsnevring av blodkarene (hvis angiografi utføres), noe som tyder på en mulig overlapping med reversibelt cerebralt vasokonstriksjonssyndrom (RCVS). Diffusjons-MR kan brukes til å identifisere områder med cytotoksisk ødem forårsaket av dårlig blodstrøm (iskemi), men det er ikke klart om dette er prognostisk relevant. Unormal tilsynelatende diffusjonskoeffisient sees i omtrent 20% av tilfellene.
I 10-25% av tilfellene av PRES er det tegn på blødning ved nevroavbildning. Ulike typer blødninger kan forekomme: blødning i selve hjernevevet (intraparenkymal blødning), sulkal subaraknoidalblødning og mikroblødninger.
Behandling
Det er ingen direkte behandling for PRES, annet enn fjerne eller behandle noen underliggende årsak. For eksempel kan det hende at immunsuppressiv medisinering må holdes tilbake. 40% av alle med PRES er uvel nok til å kreve innleggelse på intensivavdeling for nøye observasjon og behandling av komplikasjoner. De med anfall får antikonvulsiva midler.
Hvis det er en hypertensiv krise, senkes blodtrykket med 20-30% ved kontinuerlig infusjon av et blodtrykkssenkende legemiddel med nøye overvåking. Av de tilgjengelige blodtrykkssenkende midlene kan det hende at man må unngå nitrater, da det er en bekymring for at dette kan forverre PRES selv når man senker blodtrykket. I PRES sekundært til svangerskapsforgiftning kan magnesiumsulfat administreres.
Prognose
Ved tilstrekkelig behandling får 70-90% av mennesker med PRES fullstendig restitusjon innen timer til dager. 8–17% av mennesker med PRES dør, selv om dette ikke alltid er en direkte konsekvens av PRES.Av de som har resterende symptomer etter PRES, kan dette i stor grad tilskrives blødning. Ikke-oppløsning av MR-abnormiteter har vært knyttet til dårligere resultater. Hvis PRES var forårsaket av svangerskapsforgiftning, er prognosen bedre enn i PRES på grunn av andre årsaker.
Faktorer som forutsier dårligere prognoser er personens alder, nivået av C-reaktivt protein i blodet ( en markør for betennelse), endret mental tilstand på diagnosetidspunktet, og endrede markører for koagulering. Personer med diabetes kan ha dårligere utfall, og abnormiteter i corpus callosum på MR har vært knyttet til dårligere prognose. Noen mønstre på elektroencefalografi ( EEG) er også assosiert med et dårligere utfall.
Etter en episode av PRES, selv når det var assosiert med krampeaktivitet, er det bare en liten andel av mennesker som fortsatt er i fare for pågående anfall, og flertallet kan til slutt slutte antikonvulsiv behandling.
Epidemiologi
Forekomsten (antall tilfeller per år) av PRES er ikke kjent, men økende bruk av MR-skanninger har ført til økt anerkjennelse.
Historie
PRES ble først beskrevet i 1996 i en gruppe på 15 pasienter ble identifisert med tilbakevirkende kraft i journalene fra New England Medical Center i Boston og Hôpital Sainte Anne i Paris. Navnet ble revidert i 2000 fra «leukencephalopathy» til «encefalopathy» da førstnevnte antydet at det bare påvirker den hvite substansen i hjernen, noe som ikke er tilfelle.
- ICD-10: I67.83
- ICD-9-CM: 348.39
- MeSH : D054038
- SykdommerDB: 10460
