![]()
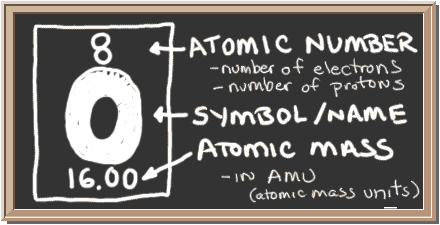
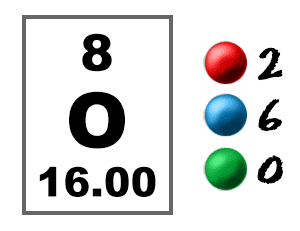
Bekijk het schoolbord. Dat vak aan de linkerkant bevat alle informatie die u over één element moet weten. Het vertelt je de massa van een atoom, hoeveel stukjes erin zitten en waar het op het periodiek systeem moet worden geplaatst.
In de volgende sectie gaan we het hebben over elektronen-orbitalen of elektronenschillen. Dit kan een nieuwe onderwerp voor sommigen van jullie.
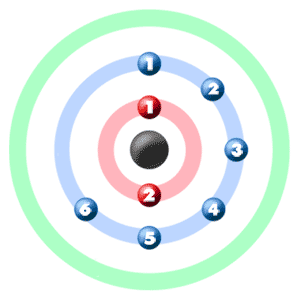
Bekijk de onderstaande afbeelding. Elk van die gekleurde ballen is een elektron. In een atoom draaien de elektronen rond het centrum, ook wel de kern genoemd. De elektronen bevinden zich graag in afzonderlijke schillen / orbitalen. Schil nummer één kan slechts 2 elektronen bevatten, schaal twee kan er 8 bevatten, en voor de eerste achttien elementen kan schaal drie maximaal acht elektronen bevatten. Als je leert over elementen met meer dan achttien elektronen, zul je zien dat schil drie kan meer dan acht schil bevatten. Zodra een schil vol is, moet het volgende elektron dat wordt toegevoegd naar de volgende schil gaan.
Dus … voor het element ZUURSTOF weet je al dat het atoomnummer je het nummer vertelt van elektronen. Dat betekent dat er 8 elektronen in een zuurstofatoom zitten. Kijkend naar de afbeelding, je c en zie er zijn twee elektronen in schil één en zes in schil twee.