Réversible syndrome de leucoencéphalopathie postérieure (RPLS)
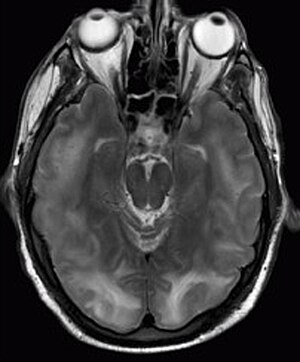
Syndrome d’encéphalopathie postérieure réversible visible à l’imagerie par résonance magnétique sous forme de cortico multiple -des zones sous-corticales du signal hyperintense pondéré T2 (blanc) impliquant les lobes occipital et pariétal bilatéralement et pons.
Neurologie
Convulsions, maux de tête, troubles visuels, altération de l’état mental, parfois faiblesse des membres ou incapacité à parler
Hémorragie intracrânienne
Le syndrome d’encéphalopathie postérieure réversible (PRES), également connu sous le nom de syndrome de leucoencéphalopathie postérieure réversible (RPLS), est une maladie rare dans laquelle des parties du cerveau sont affectées par un gonflement, généralement en raison d’une cause sous-jacente. Une personne atteinte de SEPR peut éprouver des maux de tête, des changements de vision et des convulsions, avec certains autres symptômes neurologiques en développement tels que la confusion ou la faiblesse d’un ou plusieurs membres. Le nom de la maladie comprend le mot «postérieur» car il affecte principalement mais non exclusivement l’arrière du cerveau (les lobes pariétal et occipital). Les causes sous-jacentes courantes sont une pression artérielle sévèrement élevée, une insuffisance rénale, des infections graves, certains médicaments, certaines maladies auto-immunes et la pré-éclampsie. Le diagnostic est généralement posé par scintigraphie cérébrale (IRM) sur laquelle des zones de gonflement peuvent être identifiées.
Le traitement du PRES est de soutien: élimination de la ou des causes et traitement de l’une des complications, telles que anticonvulsivants pour les crises. Le PRES peut être compliqué par une hémorragie intracrânienne, mais cela est relativement rare. La majorité des gens se rétablissent complètement, bien que certains puissent ressentir des symptômes résiduels. Le PRES a été décrit pour la première fois en 1996.
Signes et symptômes
Le PRES a généralement un début aigu. La plupart des personnes atteintes de PRES ont des maux de tête et des convulsions; beaucoup éprouvent également des changements visuels, de la confusion et de la somnolence, une faiblesse du bras et / ou de la jambe d’un côté du corps (hémiplégie), des difficultés à parler ou plus rarement d’autres symptômes neurologiques. Les changements visuels dans le SEPR peuvent inclure une hémianopsie (incapacité à voir la partie gauche ou droite du champ visuel), une vision floue, un manque de conscience visuelle d’un côté, des hallucinations visuelles et une cécité corticale.
Des crises se produisent dans environ les deux tiers des cas. Chez les enfants, c’est encore plus fréquent, à 90%. Si des crises surviennent, elles peuvent être focales ou généralisées. Une petite proportion développe un état de mal épileptique, où les crises ne sont pas contrôlées par des mesures simples.
Causes
Les causes qui peuvent contribuer au développement du PRES sont: l’immunosuppression (en particulier pour la transplantation d’organe, par exemple avec tacrolimus), infection sévère et / ou septicémie, chimiothérapie, maladie auto-immune et pré-éclampsie. L’hypertension artérielle est souvent présente. De même, la majorité des personnes atteintes de SEPR ont une fonction rénale altérée, et 21% reçoivent une hémodialyse régulière. Dans les PRES liés aux médicaments, un intervalle de plusieurs semaines à plusieurs mois peut s’écouler entre le début du traitement et le développement du PRES. Après une greffe de cellules souches hématopoïétiques (greffe de moelle osseuse), le risque de PRES est d’environ 8%, alors que le risque est plus faible (0,4-6%) après une greffe d’organe solide.
Les conditions auto-immunes suivantes ont été associé au PRES: purpura thrombocytopénique thrombotique (TTP), cholangite sclérosante primitive (PSC), polyarthrite rhumatoïde (PR), syndrome de Sjögren, polyartérite noueuse (PAN), sclérose systémique, lupus érythémateux disséminé (LED), granulomatose avec polyangéite ( GPA), la maladie de Crohn et la neuromyélite optique (NMO), ainsi que le syndrome hémolytique et urémique (SHU). Un certain nombre d’autres associations ont également été signalées, y compris certains autres groupes de médicaments, transfusion sanguine, taux de calcium élevés, diminution taux de magnésium, angiopathie cérébrale post-partum et toxicomanie (cocaïne et amphétamine).
Il a été suggéré que le PRES est identique ou étroitement lié à l’encéphalopathie hypertensive, à la présence de symptômes neurologiques chez ceux qui ont une urgence hypertensive.
Mécanisme
Bien que le mécanisme précis du PRES ne soit pas entièrement compris, il est considéré comme lié à un problème avec les vaisseaux sanguins du cerveau. Il existe plusieurs théories expliquant pourquoi ces vaisseaux sanguins peuvent devenir indûment perméables et permettre au tissu cérébral environnant de devenir enflé. La théorie «vasogénique» postule qu’une pression artérielle extrêmement élevée surmonte la capacité normale des vaisseaux sanguins du cerveau à maintenir un flux sanguin cérébral normal. La pression excessive endommage la couche endothéliale et la barrière hémato-encéphalique, entraînant un gonflement (œdème).Cela affecte principalement les parties «postérieures» du cerveau qui sont plus sensibles. La théorie «vasogénique» semble expliquer les près de 50% des cas de PRES où il y avait eu une pression artérielle sévèrement élevée. On l’appelle aussi la théorie de la « percée » ou la « théorie de l’hyperperfusion ». Cette théorie n’explique pas l’œdème dans de nombreux autres cas où la pression artérielle a été normale ou même basse; en fait, l’œdème a tendance à être plus sévère chez les personnes sans tension artérielle anormalement élevée.
En cas de PRES secondaire à d’autres causes, la lésion des vaisseaux sanguins a été attribuée à d’autres mécanismes. La théorie «cytotoxique» suggère que ce sont des dommages cellulaires directs par des toxines (généralement des médicaments) qui précipitent l’œdème. La théorie «immunogène» suggère un rôle pour le système immunitaire (en particulier les cellules T). Certains considèrent les théories cytotoxiques et immunogènes ensemble comme une seule théorie «toxique». Il semble que les cytokines jouent un rôle dans le dysfonctionnement endothélial.
Enfin, selon la théorie des « neuropeptides / vasoconstriction cérébrale », certaines substances spécifiques (endothéline 1, thromboxane A2) déclenchent des spasmes des vaisseaux sanguins avec lésions et œdèmes de la paroi vasculaire qui en résultent Cette dernière hypothèse est étayée par la découverte fréquente de spasmes diffus des vaisseaux sanguins (vasoconstriction) chez de nombreuses personnes atteintes de SEPR, et par la preuve d’une diminution de la perfusion, bien que le spasme puisse également être une conséquence des dommages aux vaisseaux sanguins plutôt que la cause. Certains, par conséquent, incluent le vasospasme dans la théorie «toxique». Il est probable que ces multiples mécanismes jouent tous potentiellement un rôle dans le développement du PRES.
Diagnostic
Il n’existe pas de critères de diagnostic formels pour le PRES, mais il a été proposé que le PRES peut être diagnostiqué si une personne a développé des symptômes neurologiques aigus (convulsions, altération de l’état mental, maux de tête, troubles visuels) associés à un ou plusieurs facteurs de risque connus, à une apparence typique à l’imagerie cérébrale (ou à l’imagerie normale) et à aucun autre diagnostic alternatif. Certains considèrent que les anomalies doivent être démontrées comme étant réversibles. Si une ponction lombaire est pratiquée, cela peut montrer une augmentation des taux de protéines mais pas de globules blancs. La numérisation par tomodensitométrie peut être effectuée dans un premier temps; cela peut montrer des zones de substance blanche de faible densité dans les lobes postérieurs.
Le diagnostic est généralement posé par imagerie par résonance magnétique du cerveau. Les résultats les plus caractéristiques de la PRES sont des hyperintensités symétriques sur l’imagerie pondérée en T2 dans les lobes pariétaux et occipitaux; ce modèle est présent dans plus de la moitié des cas. Les séquences FLAIR peuvent être meilleures pour montrer ces anomalies. Certains autres modèles rares spécifiques ont été décrits: le modèle de bassin versant du sulcus frontal supérieur (SFS), un modèle de bassin versant impliquant tout l’hémisphère (holohémisphérique) et un modèle central avec œdème vasogène dans la substance blanche profonde, les noyaux gris centraux, les thalamus, le tronc cérébral et pons. Ces schémas distincts ne sont généralement pas corrélés avec la nature des symptômes ou leur gravité, bien qu’un œdème sévère puisse suggérer un pronostic plus sombre. Si les apparences ne sont pas typiques, d’autres causes des symptômes et des anomalies d’imagerie doivent être prises en compte avant que le SEPR puisse être diagnostiqué de manière concluante. Dans de nombreux cas, il existe des signes de constriction des vaisseaux sanguins (si une angiographie est réalisée), suggérant un chevauchement possible avec le syndrome de vasoconstriction cérébrale réversible (RCVS). L’IRM de diffusion peut être utilisée pour identifier les zones d’œdème cytotoxique causé par une mauvaise circulation sanguine (ischémie), mais il n’est pas clair si cela est pertinent sur le plan pronostique. Un coefficient de diffusion apparent anormal est observé dans environ 20% des cas.
Dans 10 à 25% des cas de PRES, il existe des signes d’hémorragie en neuroimagerie. Différents types d’hémorragie peuvent survenir: hémorragie dans le tissu cérébral lui-même (hémorragie intraparenchymateuse), hémorragie sous-arachnoïdienne sulcale et micro-saignements.
Traitement
Il n’y a pas de traitement direct pour le PRES, autre que éliminer ou traiter toute cause sous-jacente. Par exemple, les médicaments immunosuppresseurs peuvent devoir être suspendus. 40% de toutes les personnes atteintes de PRES sont suffisamment malades pour nécessiter une admission dans une unité de soins intensifs pour une observation étroite et le traitement des complications. Les personnes souffrant de convulsions reçoivent des anticonvulsivants.
En cas d’urgence hypertensive, la pression artérielle est abaissée de 20 à 30% par perfusion continue d’un médicament antihypertenseur sous surveillance étroite. Parmi les agents abaissant la pression artérielle disponibles, les nitrates peuvent devoir être évités car on craint que cela puisse aggraver le PRES même tout en abaissant la pression artérielle. En cas de PRES secondaire à la pré-éclampsie, du sulfate de magnésium peut être administré.
Pronostic
Avec un traitement adéquat, 70 à 90% des personnes atteintes de PRES récupèrent complètement en quelques heures à quelques jours. 8 à 17% des personnes atteintes de PRES meurent, bien que ce ne soit pas toujours une conséquence directe du PRES.Parmi ceux qui présentent des symptômes résiduels après une PRES, cela est largement attribuable à une hémorragie. La non-résolution des anomalies IRM a été associée à de moins bons résultats. Si le PRES a été causé par une pré-éclampsie, le pronostic est meilleur que celui du PRES en raison d’autres causes.
Les facteurs qui prédisent un pronostic plus mauvais sont l’âge de la personne, le niveau de protéine C-réactive dans le sang ( ( EEG) sont également associés à un résultat moins bon.
Après un épisode de PRES, même lorsqu’il était associé à une activité épileptique, seule une petite proportion de personnes reste à risque de crises épileptiques en cours et la majorité peut éventuellement arrêter traitement anticonvulsivant.
Épidémiologie
L’incidence (nombre de cas par an) de PRES n’est pas connue, mais l’utilisation croissante des IRM a conduit à une reconnaissance accrue.
Histoire
PRES a été décrit pour la première fois en 1996 dans un groupe de 15 patients identifiés rétrospectivement dans les dossiers du New England Medical Center à Boston et de l’hôpital Sainte Anne à Paris. Le nom a été révisé en 2000 de « leucencéphalopathie » à « encéphalopathie » car le premier suggérait qu’il n’affecte que la substance blanche du cerveau, ce qui n’est pas le cas.
- CIM-10: I67.83
- CIM-9-CM: 348.39
- MeSH : D054038
- Maladies BD: 10460
